Как формировать помидоры в теплице пошаговое фото схема
На чтение 11 мин.Просмотров804ОпубликованоОбновлено
Выращивая томаты в теплице, огородники подбирают определенные их виды и сорта. Кто-то при выборе на первое место ставит вкусовые качества, кто-то урожайность, а для кого-то главным является легкость выращивания. Из-за ограничений по высоте в теплицу ведь даже не каждый помидорный куст может поместиться. Но опытные огородники знают, что любой вид томатов можно приспособить для любой теплицы, если вовремя сформировать куст так, как это нужно человеку. Итак, давайте разбираться, как формировать помидоры в теплице.
Зачем нужно формировать помидоры
Своевременный контроль со стороны человека над развитием кустов нужен по нескольким причинам. Главная из них — это заставить растение от вегетативного этапа развития перейти к цветению, завязыванию и созреванию плодов.
Кроме этого, благодаря формировке, человек влияет на урожайность, вкусовые качества и размер и массу плодов. Формированием помидорных кустов заниматься не только полезно, но и интересно.
Как правильно формировать помидоры
Перед тем, как приступить к выращиванию томатов, необходимо определиться какие условия для роста можно создать в той или иной теплице. Ведь в генах заложены сортовые особенности, благодаря которым они могут либо тянуться вверх на высоту до 7 м и выбрасывать новые цветочные кисти весь теплый сезон (индетерминантные виды), либо вершковаться и останавливаться в росте уже после того, как достигнут высоты в 50 см (детерминантные).
Огородник должен учитывать не только высоту потолков, но размеры площадей теплицы.
Формирование человеком кустов томатов начинается через 10-14 дней после того, как они были посажены в теплицу. Обычно к этому времени происходит полная адаптация рассады к новым условиям обитания. Но растения продолжают развивать свою корневую систему. Необходимые вещества для этого корни получают не только из почвы, но и листьев. Пока растение наращивает корни, до тех пор в листовых пазухах происходит активное нарастание пасынков. Тем самым куст пытается увеличить объем своей зеленой массы, для того, чтобы увеличивать свой рост и в высоту, и в ширину.
Но слишком высокий помидорный куст абсолютно не нужен человеку в небольшой тепличке. Ведь в результате получится цветущее дерево с густой кроной и мелкими плодами. Поэтому и приходится принимать меры для того, чтобы удалить лишние побеги-пасынки и в какое-то время полностью остановить рост куста. Процесс формирования помидоров включает в себя пасынкование боковых побегов, прищипывание точек роста, удаление листьев и подвязывание кустов.
Ведь в результате получится цветущее дерево с густой кроной и мелкими плодами. Поэтому и приходится принимать меры для того, чтобы удалить лишние побеги-пасынки и в какое-то время полностью остановить рост куста. Процесс формирования помидоров включает в себя пасынкование боковых побегов, прищипывание точек роста, удаление листьев и подвязывание кустов.
Что такое пасынкование
Процесс пасынкования — это работа по удалению боковых побегов, выросших из приствольных пазух листьев. Листья томатов растут прямо из ствола или бокового стебля, а пасынок появляется между стеблем и черешком листа. Первые боковые побеги обычно удаляют через 2 недели после высаживания рассады, когда их размер достигнет 3-5 см. Затем проводят ежедневный осмотр и по мере появления пазушных отростков необходимой длины проводят дальнейшее пасынкование.
Как формировать кусты томатов: видео
Как правильно пасынковать помидоры
Пасынкование будет менее травматично, если его провести в утренние часы, когда хрупкость стебля самая высокая. В этом случае пасынки можно выломать руками. Проводить процедуру лучше в перчатках. Пасынок наклоняют под углом в сторону и большим пальцем надавливают на черешок. В этом случае произойдет полное удаление пасынка.
Если процедура проводится в более теплое время, когда эластичность тканей стеблей высокая и они гнутся, а не ломаются, удаление побегов проводят с помощью ножниц или ножа. В этом случае черешок пасынка можно срезать не полностью, а оставлять небольшой пенек. Опыт огородников показывает, что в тех пазухах, в которых пасынок удален полностью, происходит быстрое отрастание новых побегов.
Проводить пасынкование необходимо в первой половине дня, чтобы за оставшееся до ночного покоя время, растение успело затянуть раны тонкой пленкой. Это поможет не допустить попадания инфекции в капиллярную систему сосудов томатов.
Как правильно обрезать пасынки и листья у помидоров: видео
Как правильно подвязать помидоры в теплице
Главной целью подвязки томатных кустов в теплице является защита растений от поломок центрального стебля. Подвязанные растения легко поддаются уходу и формировке, хорошо освещаются солнцем и проветриваются. Зафиксированные вертикальным образом кусты не контактируют с грунтом, что предотвращает фитофтороз и защищает от почвенных вредителей.
В зависимости от запланированной высоты куста выбирают способ подвязки. Колья или прутья обычно применяют для среднерослых помидоров. Высота заготовки, сделанной из дерева, пластика или металла должна быть выше предполагаемого роста растения на 30-40 см. При этом необходимо учитывать размер того куска прута, который будет помещен в землю. Каждому растению необходим свой колышек, к которому его присоединяют с помощью тканевых и пластиковых полос или специальных многоразовых хомутиков.
Подвязка должна быть достаточно плотной, но в то же время необходимо сохранять зазор между стеблем и опорой, чтобы не наносить травм растению. Первую подвязку проводят, когда растение не достигло максимального роста, поэтому по мере вытягивания центрального стебля проводят его дальнейшую подвязку. Это сохранит устойчивость и облегчит проведение поливов, подкормок, сбора урожая.
Для высокорослых томатов обустраивают шпалеры или потолочные крюки, к которым подвязывают индивидуальные куски шпагата или веревки. Если на шпалерах натянуто несколько горизонтальных рядов проволоки или толстого шнура, то ветви можно прикрепить в нескольких местах. Постепенно растение обовьет все опорные ряды и плотно закрепится на шпалере.
Прикрепление к индивидуальным натянутым вертикально шнурам начинают с нижней части ствола. К нему под нижним листом привязывают шпагат, так, чтобы оставался промежуток между стволом и узлом на шпагате. Зачастую веревку привязывают не внизу растения, а к колышку, вбитому в корневой зоне куста.
Читайте наши статьи о делах огородных:
Когда начинать формирование томатов
Формирование помидоров начинают с пасынкования. Первые боковые побеги удаляют после того, как рассада прижилась — через 10-14 дней после пересадки. Время прищипывание точки роста основных стеблей (одного и нескольких) в неотапливаемой теплице необходимо сделать за 20 дней до того, когда длительность светового дня уменьшится, а температура воздуха в ней снизится до уровня + 15°С, когда помидоры больше не смогут наливаться.
Как формировать помидоры
Формирование томатов проводится на усмотрение садовода и зависит от количества растений, посаженных в теплицу и от их способности разрастаться.
В один стебель
Выращивание кустов без боковых побегов с одним центральным стволом практикуют для высокорослых видов томатов. В этом случае все боковые побеги удаляются, а прищипывание центральной точки роста проводят после завязывания 5-8 кистей.
В этом случае все боковые побеги удаляются, а прищипывание центральной точки роста проводят после завязывания 5-8 кистей.
В два стебля
В два стебля формируют высокорослые и среднерослые томаты. Вторым стеблем становится ближний снизу к первой плодовой кисти пазушный побег. Все остальные пасынки, появляющиеся как на центральном, так и на втором стебле, удаляются.
Способы формирования
Формированием куста огородники занимаются весь сезон выращивания плодов. Кроме двух основных способов существуют вариативные виды формировок, которые применяются как для высокорослых растений, так и для остальных видов.
Индетерминантных томатов
Высокорослые томаты способны к плодоношению длительное время, — до тех пор, пока позволяют климатические условия. Но в любительских теплицах высота потолочных перекрытий не всегда позволяет растению развиваться до наступления холодов. Дополнительным формированием куста, выращиваемого по одностеблевому принципу, можно продлить срок плодоношения.
Уменьшить высоту куста с сохранением длины стебля можно только в том случае, если пространство вокруг растения не заполнено листьями рядом расположенных кустов. Ведь после созревания нижних кистей обычно удаляют и листья, растущие ниже еще не полностью налитых и покрасневших плодов.
Стебли высокорослых помидоров, подвязанных к вертикально расположенному шпагату, приспускают к земле и прикрепляют к дополнительно вбитому в землю колу. Таким образом верхушка отдаляется от потолка теплицы, что делает возможным дальнейшее плодоношение.
Детерминантных томатов
Урожайность детерминантных (ограниченных в росте) томатов во многом зависит от того насколько формирование усилило жизнеспособность растения. Так как кусты могут достигать высоты 1 м и более, то именно от выбранного способа формирования будет зависеть общая длина плодоносных стволов. Наиболее продуктивным считается метод выращивания детерминантного растения в 3 стебля.
Самостоятельное прекращение роста основного стебля у этих видов наступает после образования 5-6 кистей. Поэтому томат растет в один стебель, пока не завяжется 4-я кисть. После этого дают возможность развиться ближнему с низу к кисти боковому пасынку. После завязывания 2-х кистей на боковом стебле оставляют еще один пасынок. Такой вариант роста растения позволяет не перегружать его в начале плодоношения, и дает возможность развиться сильной корневой системе.
Поэтому томат растет в один стебель, пока не завяжется 4-я кисть. После этого дают возможность развиться ближнему с низу к кисти боковому пасынку. После завязывания 2-х кистей на боковом стебле оставляют еще один пасынок. Такой вариант роста растения позволяет не перегружать его в начале плодоношения, и дает возможность развиться сильной корневой системе.
Супердетерминантных томатов
Такие виды томатов отличаются низкорослостью и скороспелостью. Супердетерминантные кусты быстро и дружно созревают и больше не плодоносят. Они легко переносят загущенные посадки, отращивают очень много соцветий. Первое из них обычно появляется после 6-го листа, а дальше — через один лист. После формирования первых 3-х цветоносов у растения прекращается рост боковых побегов.
Супердетерминантные томаты формируют в 1-3 стебля. Наибольший урожай получают при формировании в три. При удалении всех пасынков центральный стебель прекращает удлиняться и вершкуется.
Томатов Черри
В группу мелкоплодных томатов, объеденных под условным названием вишнеподобных (черри), входит множество столовых, салатных и пригодных для консервирования видов. Плоды черри бывают груше-, сливо- и шаровидными, овальными, гладкими и ребристыми. По высоте помидоры могут быть гигантами 3-х метрового роста и крохотными горшечными растениями. Томатные кусты черри формируют много пасынков. Боковые побеги отрастают практически в каждой листовой пазухе. Стебли у них тонкие, нуждающиеся в обязательной подвязке.
Плоды черри бывают груше-, сливо- и шаровидными, овальными, гладкими и ребристыми. По высоте помидоры могут быть гигантами 3-х метрового роста и крохотными горшечными растениями. Томатные кусты черри формируют много пасынков. Боковые побеги отрастают практически в каждой листовой пазухе. Стебли у них тонкие, нуждающиеся в обязательной подвязке.
Низкорослые виды томатов черри не нуждаются в удалении пасынков, их вырастает не более 3-х штук. Кустики получаются компактными, практически без разветвлений. Среднерослые помидоры ведут в 1-2 стебля. Но так как эти виды черри склонны к вершкованию, под каждой новой кистью оставляют резервный боковой побег, удаляя предыдущий пасынок. Высокорослые формируют в один-два ствола или многостеблевыми, оставляя 3-4 боковых побега.
Как вырастить томаты черри: видео
Прищипывание верхушек у томатов
Для искусственного завершения роста плодоносящих стеблей проводят прищипывания их верхушек.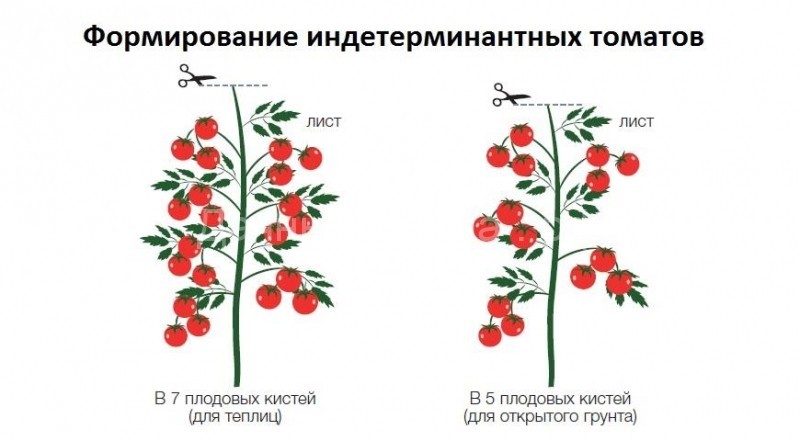
Отзывы
Ольга, 53 года, Иваново
Выращиваю томаты черри в своей теплице уже не первый раз, но никогда не могла вырастить высокорослые. Рано у нас наступают холода, а так хочется, чтобы этих томатиков было побольше.
Николай, 63 года, Великие Луки
Урожайность помидоров в теплице конечно же зависит не только от ухода за почвой, но и от грамотного подхода к формированию. Если не будут созданы условия для хорошего освещения, то значит и томаты не наберут ту массу, которую нам пообещали производители семян. В этом случае винить нужно только себя.
Задать вопрос
Регулярно проводимые работы по формированию помидоров требуют определенных усилий и аккуратности.Здоровья Вам и Вашим близким!
Как Вам статья?
Полезная статья!1Так себеКак формировать помидоры в теплице и открытом грунте
На чтение 14 мин. Просмотров 228 Обновлено
Иногда томаты не соответствуют сортовому описанию – дают скудный урожай, мелкие плоды и вообще только занимают место на грядке. И все это при дозированном поливе и подкормках. Виноваты сами огородники, игнорирующие или проводящие формирование томатов неправильно.
Некоторые считают операцию слишком сложной и стараются с ней не связываться. Тогда остается выращивать низкорослые штамбовые сорта, удобные в открытом грунте, но малопригодные для теплиц или все-таки учиться правильно формировать томаты.
Зачем формируют кусты помидоров
Фактически первый шаг по формировке томатов огородники делают во время пикирования рассады. Даже если корешок не прищипывают специально, он сам обрывается и становится немного короче. Это дает толчок образованию боковых сосущих отростков, позволяющих лучше усваивать влагу и питательные вещества из верхних слоев грунта.
Формирование томатов состоит из нескольких операций:
- пасынкование;
- нормирование цветочных кистей;
- удаление лишних листьев;
- вершкование;
- ведение и подвязка стебля.
У кистевых сортов могут проводить нормирование, но не делают прищипывание плодовых гроздей. Для помидоров черри не рекомендуются обе операции.
Чтобы вырастить плоды-рекордсмены нормирование и прищипывание кистей проводят обязательно.
Все процедуры по формовке связаны между собой и преследуют единственную цель – получение высокого урожая качественных томатов. Иначе куст:
- наращивает зеленую массу в ущерб плодоношению;
- загущается, вследствие чего плохо проветривается и часто болеет;
- побеги и листья затеняют друг друга и завязи, что мешает фотосинтезу;
- требует повышенных поливов и подкормок;
- корневая система не в силах обеспечить питанием всю надземную часть;
- томаты обильно цветут, но плоды плохо завязываются, долго зреют, вырастают гораздо мельче, чем указано в описании сорта;
- на высоких кустах успевают поспеть только нижние кисти.
Формирование томатов в открытом грунте и теплицах позволяет:
- получить больший урожай;
- повысить товарные и потребительские качества плодов, в том числе вкус, размер и сахаристость;
- перераспределить питательные и пластические вещества, направив их на формирование и созревание завязей, а не наращивание зеленой массы;
- осветлить куст;
- снизить вероятность появления грибных, вирусных и бактериальных инфекций;
- упростить обработки от вредителей и болезней;
- убрать бесполезные побеги, не дающие урожая, а только расходующие питательные вещества;
- ускорить созревание плодов примерно на 5-7 дней;
- уменьшить количество поливов и подкормок;
- сделать уход проще;
- сэкономить место на грядке, в теплице или парнике.

Какие сорта нужно формировать
Единственно верного способа, как правильно формировать помидоры всех сортов не существует. Это зависит от следующих факторов:
- характера роста куста – чем выше томат, тем в большей формировке он нуждается;
- способа и места выращивания – существуют особенности операции для открытого и защищенного грунта;
- умений хозяина – ничего нет проще, как формировать томаты в один стебель, а вот если оставить 3 или 4, может допустить ошибку даже опытный огородник.
Сейчас определять принадлежность сорта или гибрида к той или иной разновидности нужно по высоте томата и способности самостоятельно ограничивать рост. Количество междоузлий (листьев) до формирования первой кисти уже не всегда является определяющим показателем.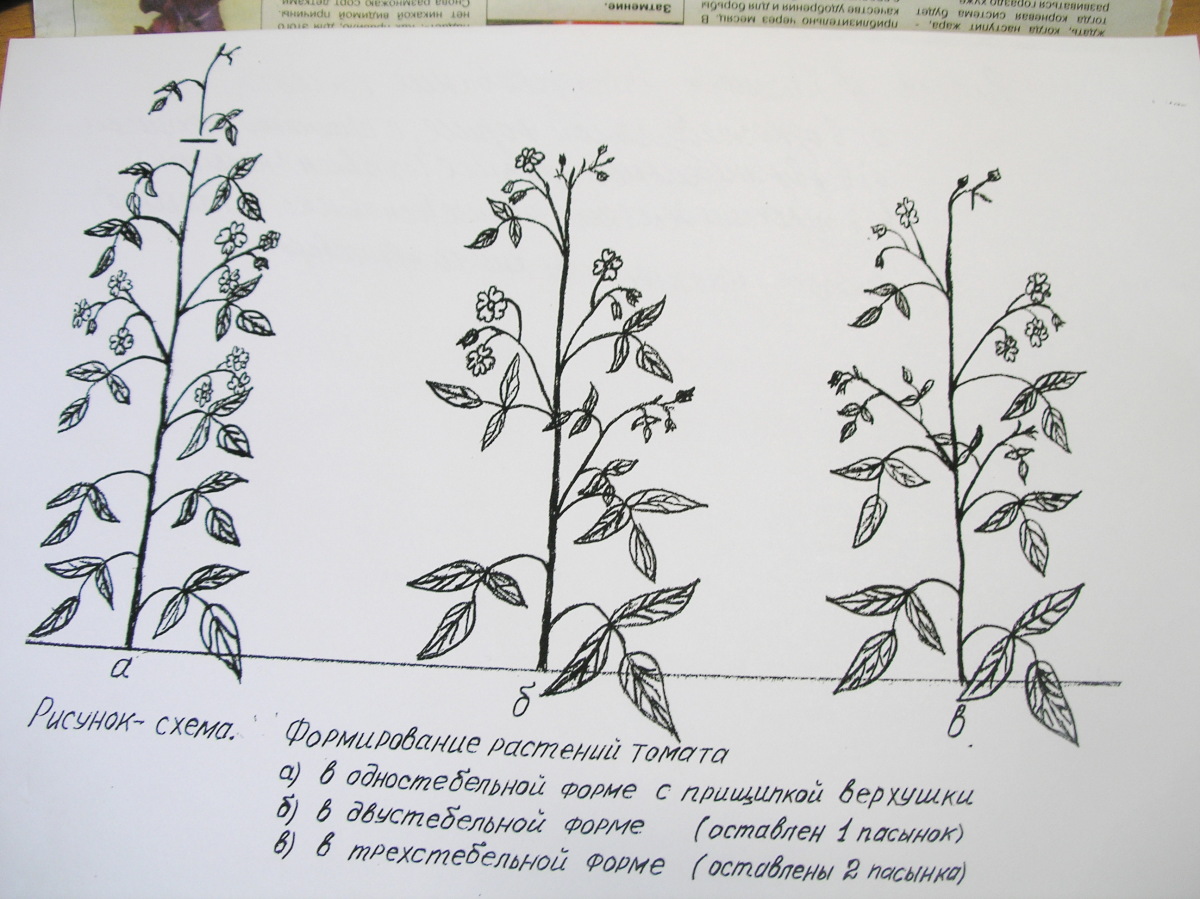
Селекционеры стараются выводить сорта, завязывающие плоды как можно раньше. Это ускоряет созревание, позволяет экономить место. Один из способов – заставить появиться цветочную кисть на междоузлие или два ниже.
Учитывая, что помидоры в теплице из поликарбоната обязательно формируются и растут гораздо выше, чем в открытом грунте, некоторые практики вообще склонны делить их только на две категории. Индетерминантные – с неограниченным ростом, и детерминантные, у которых макушка прекращает тянуться вверх после формирования определенного количества кистей.
Штамбовые
Это разновидность супердетерминантных помидоров, не нуждающихся в формировании. Сорта и гибриды на главном побеге дают 2-3 кисти, основной урожай снимается с пасынков.
У них удаляют только отходящие от уровня грунта боковые побеги и самые нижние листья, чтобы они не ложились на землю. Иначе куст станет легкой добычей для болезнетворных микроорганизмов и находящихся в почве вредителей.
Супердетерминантные
В открытом грунте растут как есть, убирают только вегетативные органы, указанные для штамбовых сортов. Требуется формирование куста в теплице – его ведут в 3 или 4 ствола.
Требуется формирование куста в теплице – его ведут в 3 или 4 ствола.
Супердетерминантные сорта в защищенном грунте выращивают редко, так как те отличаются небольшой урожайностью и только занимают место. Обычно там сажают несколько кустиков, чтобы получить ранние плоды для собственного потребления.
Детерминантные
У этих сортов формирование куста томатов в теплице и на открытых грядках отличаются. В грунте их ведут в 2-3 стебля. Иногда даже не подвязывают, что является существенной ошибкой. Тепличные помидоры вырастают гораздо выше, часто – в 1,5 или 2 раза, чем в грунте.
Рекомендуется у них оставлять 1, максимум – 2 стебля. Опытные огородники указывают, что ведение в 3 ствола существенно усложняет формовку и уход, а урожайность не повышает.
Детерминантные помидоры нуждаются в пасынковании, удалении листьев, подвязках, для получения крупных плодов кисти нормируют. Вершкования обычно не проводят.
Полудетерминантные
В продажу полудетерминантные сорта могут поступать как детерминантные или индетерминантные, особенно если семена фасуют небольшие фирмы или любители. От первых отличаются по высоте и количеству плодовых кистей – их не 5-6, а 8-10. Формируются же обычно, как индетерминантные.
От первых отличаются по высоте и количеству плодовых кистей – их не 5-6, а 8-10. Формируются же обычно, как индетерминантные.
В открытом грунте такие сорта выращивать не рекомендуется. Условия России позволяют вызреть нижним кистям, остальные с наступлением холодов остаются зелеными или только начинают цвести. Учитывая, что обычно полудетерминантные сорта – поздние или среднепоздние, сажать их на открытых грядках просто не имеет смысла. К тому же формировать и вести высокий куст там довольно тяжело.
Полудетерминантные сорта подвязывают, пасынкуют, удаляют нижние листья. Нормирование завязей – по желанию огородника. Вершкование в грунте обязательно. В теплице зависит от того, успеют ли вызреть все 8-10 кистей.
Нужно ли прищипывать верхушку, можно рассчитать. С момента формирования кисти до созревания плодов проходит не меньше 1,5 месяцев. Когда в теплицах становится достаточно холодно, чтобы закончить сезон, огородник знает. На это и следует ориентироваться.
Индетерминантные
Эти сорта сажают только в защищенном грунте. Формирование индетерминантных томатов проводят в 1 стебель, если другое не указано в сортовом описании. Они нуждаются в вершковании.
Те огородники, которые пытались вести кусты в 2-3 стебля, обычно на следующий год оставляют один. Несколько стволов прибавляют забот, уменьшают полезную площадь, но не увеличивают урожай.
Формируют индетерминантные помидоры так же, как полудетерминантные. Только вершкование проводят обязательно.
Удаление пасынков
Пасынкование начинают не раньше, чем зацветет первая кисть. Специалисты советуют это делать примерно через 2 недели после высадки рассады, чтобы томат успел укорениться и легко перенес операцию.
Удалять боковые отростки можно ножницами или руками – это несущественно. Важно, чтобы он не перерос. Чем раньше пасынок уберут, тем лучше. Удаление стеблей в 10 см и более необходимо, но уже является для культуры стрессовым фактором. Даже занятым огородникам рекомендуется проводить пасынкование раз в неделю. Или выбирать сорта, дающие мало боковых побегов.
Или выбирать сорта, дающие мало боковых побегов.
Если куст будут вести в несколько стволов, оставляют пасынок, сформировавшийся под первой цветочной кистью. Для второго и третьего (если нужно) – через несколько междоузлий. Но они тоже должны располагаться под, а не над кистью.
Перенаправление точки роста
Есть высокие томаты, дающие максимальный урожай только при переведении точки роста на боковой побег. Обычно на это указывают в сортовом описании. В качестве замены оставляют пасынок под нижней цветочной кистью.
На основном стебле рекомендуется дать сформироваться еще 1-2 завязям и только потом провести вершкование. С выбранным пасынком обращаются так, как будто это и есть главный стебель – подвязывают, убирают боковые побеги, при необходимости ограничивают рост в конце сезона.
Удаление нижних листьев
После того как плодовая кисть сформирована и начала наливаться, рекомендуется удалить находящиеся под ней листья. Это ускорит созревание томатов и улучшит вентиляцию куста.
Ранее нижние листья служили для помидоров источником питания и пластических веществ, но успели выполнить свою функцию и только мешают. Они требуют удобрений и влаги, а в фотосинтезе уже не участвуют. С удалением пластин куст становится более устойчивым к засухе.
По мере наливания следующих кистей обрезают или обрывают и листья, находящиеся под ними. Но иногда, особенно жарким летом, пластины затеняют плоды и не дают им «спечься». Тогда защищающие помидоры листья оставляют целиком или частично. Обрезать можно один или несколько сегментов.
Чтобы томат развивался нормально, все листья удалять нельзя. На высокорослом кусте их должно оставаться не менее 25-30.
У сортов томатов, не нуждающихся в пасынковании, обычно не удаляют и нижние листья под начавшей наливаться кистью. Но если куст сформировать правильно, и все-таки убирать нижние пластины, он будет лучше проветриваться, что снизит вероятность инфицирования. А плоды получат больше света. Это повысит их сахаристость и позволит вырасти крупнее.
Это повысит их сахаристость и позволит вырасти крупнее.
Перед удалением листьев грунт должен немного просохнуть. Полив проводят не раньше, чем через сутки после обрезки пластин. Это не даст плодам растрескаться.
Прищипывание верхушек
От момента выдвижения цветочной кисти до созревания плодов проходит не менее 1,5 месяцев, часто – больше. Не все томаты могут налиться за короткое российское лето даже в теплице. В первую очередь это касается высокорослых сортов.
Так зачем куст будет расходовать силы и питательные вещества на плоды, которые все равно не успеют вызреть? Зная, сколько времени цветам нужно, чтобы превратиться в спелые помидоры, и когда планируется окончание сезона, легко подсчитать, как много кистей нужно сохранить.
Над верхней гроздью оставляют 2-3 листа и прищипывают верхушку. Это позволит плодам вырасти более крупными и быстрее вызреть.
Нормирование завязей
Необязательная процедура, проводится обычно в таких случаях:
- По какой-то причине, например, из-за неблагоприятных погодных условий или ошибок ухода, некоторые завязи оказались мелкими либо деформировались.
 Товарных плодов из них уже не получить, а питательные вещества оттягиваются. Такие кисти рекомендуется удалять при формировании томата полностью.
Товарных плодов из них уже не получить, а питательные вещества оттягиваются. Такие кисти рекомендуется удалять при формировании томата полностью. - На гроздьях некоторых сортов можно наблюдать, что расположенные ближе к побегу плоды крупные, а на кончиках слишком мелкие. Питательные вещества распределяются на всю кисть. Лучше убрать кончик, оставив несколько первых помидоров на каждой.
- Получить завяленные в описании сорта плоды-рекордсмены, например, 1 или 1,5-килограммовые можно, только нормируя завязи. Тогда на кусте вообще оставляют несколько помидоров. Много огромных плодов культура не в состоянии дать.
У огородников может возникнут вопрос, сколько томатов оставлять при формировании. Зная урожайность сорта и предполагаемый вес плодов, это легко подсчитать самостоятельно. Например, с куста можно собрать 5 кг помидоров массой 200-400 г. Чтобы получить сортовое соответствие оставляют 12-25 завязей. Иначе только самые первые томаты в нижних кистях дотянут до задекларированного веса.
Формирование томатов: схема
Прежде чем сажать рассаду, нужно определиться, какая схема формирования куста томата будет использована. И уже исходя из этого планировать расстояние между лунками. Следует всегда обращать внимание на рекомендации производителя семян, а еще лучше – селекционера, если таковые имеются.
В один стебель
На красочных картинках, где томаты растут ровными рядами, представляют собой толстую голую плеть, сплошь увешанную плодами, показывают именно сформированный в 1 стебель куст. Так выращивают все индетерминантные и большинство полудетерминантных сортов и гибридов, если другое не советует производитель.
Формирование очень простое. Рекомендуется для экономии места в теплице и получения крупных плодов. Так можно выращивать и детерминантные сорта в защищенном грунте.
Все пасынки удаляют. Главный стебель подвязывают. Как только на кисти плоды достигнут молочной спелости или начнут буреть, убирают нижние листья. На завязях формирование проводят по желанию. Примерно за 1,5 месяца до предполагаемого окончания сезона прищипывают верхушку.
Примерно за 1,5 месяца до предполагаемого окончания сезона прищипывают верхушку.
Если в теплице жарко и солнечно, при формировании куста можно оставить для защиты листья, прикрывающие завязи. Когда света станет меньше, их удаляют.
Единого правила, на каком расстоянии сажать сформированные в 1 стебель томаты нет, все зависит от сорта, агротехники и количества времени, которое огородник может уделить культуре. Большое значение имеет размер листьев. Обычно томаты размещают на расстоянии около 45-50 см друг от друга. При тщательном уходе и небольших листьях возможна уплотненная посадка – 30 см между кустами.
В 2 стебля
Формирование помидоров в два стебля чаще всего проводят на высокорослых сортах открытого грунта и детерминантных в теплицах. Но никто не запрещает вести таким образом и томаты с неограниченным ростом.
Обращать внимание следует на рекомендации производителей. При испытании нового сорта можно формировать несколько кустов в 2 стебля, остальные – одной плетью. По результатам сезона станет очевидно, какой способ лучше.
По результатам сезона станет очевидно, какой способ лучше.
Перед тем как формировать томаты в два стебля в теплице, следует позаботиться, чтобы кустам хватало места. Даже при уплотненной посадке расстояние между растениями не должно быть меньшим 50 см. Нужно обращать внимание на рекомендации производителя и сортовое описание.
Под первой цветочной кистью для формирования томата в 2 ствола оставляют пасынок. Его тоже подвязывают, удаляют боковые побеги и нижние листья. При необходимости прищипывают верхушку.
В 3 стебля
Формирование детерминантных томатов в открытом грунте и низкорослых сортов в теплице обычно проводят в 3 стебля. Для этого под цветочной кистью, расположенной не слишком высоко, оставляют еще один сильный пасынок.
Некоторые опытные огородники предпочитают такое формирование детерминантных томатов, если нужно получить много плодов небольшого размера. Но тут важно не запутаться. Когда стволов больше 2, а кустов много, можно случайно удалить нужный пасынок.
Недостаток схемы для формирования высокорослых томатов в 3 ствола – требуется много места. Ведь каждая плеть должна получать достаточно света. А урожайность-то при этом не меняется!
В 4 стебля
Ничем не отличается от схемы, описанной выше, только пасынков оставляют 3. Рекомендуется исключительно для формирования низкорослых томатов. Никто не запрещает так вести высокие сорта, но практика показывает, что это занятие непростое и неблагодарное. Обычно, промучившись год, огородники ведут рослые помидоры в 1 или 2 ствола.
Подпорка томатов
Только низкие штамбовые и супердетерминантные томаты не нуждаются в подвязке. Формирование остальных без опоры теряет смысл – побеги под тяжестью плодов ложатся на землю, и хорошо, если не ломаются. Индетерминантным помидорам не нужно даже перегружаться урожаем – они обязательно упадут без подвязки.
В теплицах легко устроить горизонтальную опору, закрепленную в верхнем ярусе или на потолке. К ней подвязывают толстый шнур или веревку, опускают к грунту, закрепляют в нижней части главного побега томата свободной петлей. По мере роста стебель закручивают вокруг опоры. При необходимости верхний конец веревку можно ослабить или натянуть.
По мере роста стебель закручивают вокруг опоры. При необходимости верхний конец веревку можно ослабить или натянуть.
Если формирование проводится в 2 или больше стволов, для каждого опускают индивидуальную перевязь. Главное, чтобы она не впивалась в побег, иначе перекроет поступление питательных веществ в верхнюю часть растения.
Витки не рекомендуется делать слишком часто. Чтобы они проходили непосредственно под плодовой кистью крайне нежелательно.
Гораздо сложнее подвязывать томаты при формировании в открытом грунте. Конечно, можно соорудить прочную конструкцию, достаточно высокую, чтобы подвязать к верхней перекладине рослые томаты. Но те, у кого есть такая возможность, обычно накрывают ее пленкой. И получается парник.
При формировании и подвязке высокорослых томатов на грядках огородники проявляют фантазию:
- используют высокие палки, которые следует еще вкопать, чтобы не повалило ветром или под весом куста;
- подвязывают плети к проволоке или бельевой веревке, но их нужно к чему-то прицепить, и все равно надежной опора не будет;
- натягивают сетку-рабицу, раскаляющуюся под солнцем и обжигающую побеги.

Именно поэтому низкорослые томаты рекомендуется сажать на грядки, а высокие – в теплицу. Тогда будет меньше забот. Индетерминантные сорта максимально используют полезную площадь защищенного грунта, супердетерминантные – не нуждаются в подвязках.
Типичные ошибки
Перед тем как формировать куст помидора, нужно четко понимать, чего делать нельзя:
- При ведении в несколько стволов оставлять пасынки, растущие до первой цветочной кисти. Из них ничего хорошего не получится. К тому же замедлится формирование и созревание помидоров на главном побеге.
- Оставлять нижние пасынки на штамбовых и супердетерминантных томатах, не нуждающихся в формировании. Со временем они лягут на землю и откроют дорогу болезнетворным микроорганизмам. К тому же будут мешать уходу и рыхлениям. Дождливым летом в открытом грунте могут начать гнить, и инфицируют весь куст.
- Нельзя допускать, чтобы пасынки перерастали, а тем более, зацветали. Они оттянут на себя столько полезных веществ, что ущерб можно будет возместить только внеплановыми подкормками, да и то не всегда.

- Удалять сразу много листьев. Для томатов это сильный стресс. А еще пластины испаряют воду. Если куст лишить сразу нескольких листьев, влага будет перенаправлена в плоды, и они потрескаются. Норма – 1-2 в неделю.
- Подвязывать томаты, когда они уже ложатся на грунт или сгибаются под тяжестью плодов. Стебли у культуры хрупкие, легко ломаются. Об опоре нужно заботиться одновременно с высадкой рассады.
Формирование томатов – дело не такое уж сложное. Важно правильно разместить их при посадке и все операции проводить своевременно. Только тогда можно получить хороший урожай товарных плодов, соответствующих сортовому описанию.
Что дает формирование томата в один стебель — как нужно правильно проводить процедуру: сроки, схемы, особенности
Агротехнические мероприятия по формированию томатов (пасынкование, прищипывание и удаление части листьев) — это искусственное регулирование количества и размера вегетативных органов, чтобы помочь растению сконцентрировать свои силы на завязывании плодов и их созревании.
Чтобы не навредить растению, нужно точно знать, когда, где и сколько отщипнуть или обломать. Задача у формирования одна, схемы разные. Формировать томат в один стебель не сложно, а результат хороший и по качеству урожая, и по внешнему виду куста.
Зачем формировать куст у помидор
Растения томата, в период своей вегетации на стебле, закладывают не только листья и плодовые кисти. В пазухах листьев появляются побеги (пасынки), которые в свою очередь тоже формируют вегетативные органы, в том числе новые побеги.
Внимание! Если не ограничивать рост и количество побегов, вегетативная масса куста увеличивается в геометрической прогрессии.
На такой рост тратится много питательных веществ, которые необходимы для завязывания и роста плодов. Кроме того, загущение куста способствует плохому проветриванию, развитию заболеваний, ухудшается опыление и созревание плодов. Негативные последствия: от значительного снижения урожая, до полной его гибели.
Преимущества и недостатки формирования томатов в один стебель
Растения, сформированные в один стебель, имеют ряд преимуществ:
- Посадки хорошо освещены и проветриваются, это создает благоприятные условия для роста и плодоношения. Снижается риск развития заболеваний.
- Свободный доступ для обслуживания растений и сбора урожая.
- Позволяет вырастить более крупные плоды, продлить период вегетации.
- Рационально используется полезная площадь, так как сокращается интервал между растениями.
Способ не эффективен для сортов с ограниченным ростом, если не направить рост растения в боковой побег, а также в низких защитных сооружениях. Требует устройство высокой опоры или шпалеры для подвязки.
Общие правила формирования куста в один стебель
Задержка с пасынкованием приводит к излишнему разрастанию побегов, бесцельному расходованию питательных веществ, травмированию стебля при обламывании. Большая ранка плохо засыхает и через нее происходит инфицирование.
Пасынок, подлежащий удалению должен быть не больше 5 см.
Первое пасынкование проводят через 10-14 дней после высадки рассады в грунт. К этому времени растение хорошо приживается и начинается бурный рост зеленой массы. Если рассада переросла, то первые побеги появляются уже в горшках, тогда их удаляют сразу после приживления рассады.
Как пасынковать
Пасынки лучше удалять вручную, простым выламыванием. Для этого из пазухи его наклоняют в сторону от стебля и с усилием прижимают вниз. Чтобы в пазухе от побега остался небольшой пенек, при обламывании пасынок придерживают пальцем. Наличие пенька предотвращает рост в этой пазухе нового побега.
Схема пасынкования
Формирование одного стебля для плодоношения производится следующими способами:
- классический — для формирования индетерминантных томатов в защищенном и открытом грунте:
- ступенчатый — для продления плодоношения детерминантных сортов и уменьшения стебля индетерминантных сортов без сокращения срока плодоношения;
- с боковыми пасынками — позволят получить больше урожая в нижней части растения и в более ранние сроки.

Когда и как прищипывать
Прищипывание верхушки побега (точки роста) проводят для ограничения роста, когда возникает потребность ускорить созревание уже сформировавшихся плодов на главном стебле или прекратить рост оставленного бокового побега. Проводят прищипывание вручную после 2-3 листа над последней цветочной кистью с уже распустившимися цветами.
Удаление листьев
Удаление листьев проводят параллельно с пасынкование растений. Одновременно удаляют не более 2-3 листьев ниже плодовых кистей. Излишнее удаление листьев снижает фотосинтез, а большое наличие зелени потребляет много питательных веществ, замедляет созревание, ухудшает проветривание, что способствует развитию заболеваний.
Схемы формирования томатов в один стебель
Данная схема особенно часто встречается при формировании высокорослых томатов в высоких теплицах всех типов. Это позволяет рационально использовать всю высоту теплицы. При пасынковании для плодоношения оставляют один стебель, на котором закладываются все цветочные кисти, а все образующиеся в пазухах листьев побеги удаляются.
- Схема с частичным оставлением пасынков
Если урожай нужно получить в более короткий период, если период вегетации имеет ограниченные сроки, на главном стебле оставляют несколько ранних боковых побегов. Их выращивают до образования первой цветочной кисти и прищипывают по общему правилу — после двух листов.
- Схема ступенчатого формирования
Используется, если требуется несколько замедлить рост стебля индетерминантного томата, но не остановить его. Для этого боковой побег оставляют в верхней части стебля, и он развивается параллельно. Как только на побеге появится первая цветочная кисть, главный стебель прищипывают. Теперь в роли стебля будет работать оставленный побег. Такую процедуру можно провести несколько раз, если период вегетации длинный.
Способом ступенчатого формирования можно значительно продлить плодоношение растений с ограниченным ростом.
В видео рассказываются нюансы посадки помидоров в открытый грунт при условии формирования в один стебель.
Особенности формирования стебля в теплице и открытом грунте
- В теплице.
Затраты на производство томатов в теплице достаточно высокие, поэтому необходимо обеспечивать высокую урожайность, чтобы их окупить и значительно продлить период плодоношения. Формирование томата в один стебель позволяет решить эти задачи и создать в теплице благоприятный микроклимат.
Сорта с неограниченным ростом в отапливаемых теплицах подвязывают таким образом, чтобы по мере созревания урожая нижних кистей, стебель можно было опускать вниз и укладывать на сетку или мульчу.
Это позволяет растению беспрепятственно развиваться и использовать высоту теплицы. При этом формирование проводят классическим способом.
- В открытом грунте:
- для высокорослых томатов лучше использовать формирование с оставлением боковых побегов и последующим прищипыванием точки роста;
- для среднерослых и низкорослых томатов используют ступенчатую схему формирования с переводом роста на боковой побег.

Как правильно формировать
У индетерминантных сортов урожай формируется весь вегетационный период и завершается только с наступлением неблагоприятных погодных условий или, если не хватает высоты теплицы. При выращивании этих сортов максимально используют основной стебель, удаляя боковые отростки.
Если необходимо укоротить длину стебля, но продлить плодоношение, его переносят на боковой побег и делают его основным.
У детерминантных томатов основной стебель ограничивается незначительным количеством цветочных завязей. Для увеличения их количества оставляют один или несколько побегов, которые ограничивают одной плодовой кистью. По другой схеме, оставляют последний побег перед предполагаемым вершкованием, для продолжения на нем плодоношения.
Рекомендации
Пасынковать лучше утром, после просыхания росы и при отсутствии осадков. В утренние часы побеги более сочные, хрупкие и легко обламываются, не травмируя стебель. Температура должна быть умеренной, а погода безветренной. В течение дня ранки быстро подсыхают и не инфицируются.
В течение дня ранки быстро подсыхают и не инфицируются.
При пасынковании растений с признаками заболевания, необходимо дезинфицировать руки и режущие инструменты после каждого растения. При пасынковании нужно оставлять небольшую часть побега, чтобы на месте удаленного не вырос новый.
Совет! Для выбора схемы формирования нужно точно знать физиологические особенности сорта.
Технология формирования томатного куста в один стебель доступна даже новичкам. При правильной постановке работы положительный результат будет обеспечен. Выглядеть он будет так — высокие, стройные, компактные кусты, увешанные большими кистями созревающих помидоров.
Как формировать помидоры в теплице и открытом грунте: схемы и инструкции
Многие сорта томатов, выращиваемые на открытых грядках и в теплицах, нуждаются в формировании. Это специальная процедура, заключающаяся в своевременном удалении пасынков, постепенном удалении листьев под налившейся плодовой кистью. Рассмотрим, как правильно формировать помидоры в теплице и открытом грунте в зависимости от типа куста.
Рассмотрим, как правильно формировать помидоры в теплице и открытом грунте в зависимости от типа куста.
Зачем нужно проводить формирование томатов
Многие разновидности помидоров, кроме главного стебля, пускают еще и дополнительные побеги, то есть пасынки. Они всегда появляются между листом и стеблем – в пазухах листьев – чаще по одному, но бывает и по два сразу.
Казалось бы, чем больше зеленая масса, тем больше на растениях будет плодов и, соответственно, обильнее урожай. Но это не совсем так. Наращивая стебли и листья, томаты расходуют на них немало питательных веществ, которые могли бы поступать в созревающие плоды, тем самым урожай снижается.
Еще один недостаток несформированных растений с лишней зеленой массой – из-за плохого проветривания на ней чаще и быстрее размножаются патогены, кусты начинают болеть различными вирусными и грибковыми заболеваниями. Особенно это актуально в теплицах, где из-за постоянной влажности и тепла овощные растения гораздо больше подвержены болезням.
Таким образом, формирование томатов в теплицах и в открытом грунте дает возможность кустам расти правильно, лучше противостоять вирусам, грибкам и неблагоприятным условиям, давать хороший урожай. Оно обязательно для тепличных растений, формирование же низкорослых томатов в открытом грунте проводят по желанию.
Когда нужно начинать формировать кусты помидоров
Начинать формирование томатов на домашних участках надо в определенные сроки. После пересадки рассады нужно дать ей время прижиться и адаптироваться. Обычно это занимает 2-2,5 недели, после чего молодые кусты нужно осмотреть на предмет наличия пасынков. Если они появились и оставлять их не нужно, то их немедленно удаляют. Больше 5 см отрастать они не должны. Новые пасынки появляются на томатах ориентировочно еще через 2 недели, поэтому регулярно осматривать их нужно с таким интервалом времени.
Процесс формирования куста: правила и особенности
Не все томаты в теплице из поликарбоната, пленочной, стеклянной или возделываемые на обычных грядах, формируют одинаково. Существуют специальные схемы, рекомендуемые к применению в зависимости от типа куста. Если обрезать растения в соответствии с ними, это даст им возможность развиваться наиболее правильно и проявить весь заложенный в них селекционный потенциал.
Существуют специальные схемы, рекомендуемые к применению в зависимости от типа куста. Если обрезать растения в соответствии с ними, это даст им возможность развиваться наиболее правильно и проявить весь заложенный в них селекционный потенциал.
Прищипывание лучше всего проводить по утрам, в солнечную и теплую погоду: к вечеру поврежденные места успеют подсохнуть. Для удаления пасынков используют острый нож, ножницы или просто прищипывают их руками. Срезают их не под корень, а оставляют небольшие пеньки высотой 1см. Это не позволит новым пасынкам снова вырасти в этом месте.
Индетерминантных томатов
У растений этого типа рост неограничен, обычно это высокорослые помидоры, они дают самый большой урожай. Их принято формировать в один стебель. Считается, что так питательные вещества наиболее равномерно распределяются по всем тканям, а высоты растения и так достаточно для формирования приличного числа плодов. Поэтому в процессе формирования индетерминантных томатов у них удаляют абсолютно все пасынки.
Особенности высокорослых томатов – 1-я кисть у них закладывается после 10-12 листа, соцветия — через 3 листа. Чтобы правильно сформировать помидоры, нужно определиться с числом плодовых кистей, которые нужно будет оставить на кусте:
- 7 соцветий – для тепличных;
- 5 – для грунтовых.
После того, как растения дадут последнюю кисть, над ней оставляют 1-2 листа и обрезают верхушку, чтобы томаты больше не завязывали плодов, которые не успеют созреть до наступления холодов. Нижние листья тоже удаляют, они мешают циркулированию воздуха и проветриванию почвы около кустов, срезают и пожелтевшие, увядающие. Кроме обрезки, высокорослые помидоры нуждаются в подвязке к опоре или шпалере.
Детерминантных томатов
Этот тип помидоров отличается ограниченным ростом, они дорастают только до определенной высоты (0,8-1,2 м) и закладывают 3-6 кистей. Они появляются на растениях чаще, чем на индетерминантных, — с интервалом в 1-2 листа, 1-е соцветие появляется после 8-9 листочка. Кусты помидоров этого типа формируют в зависимости от способа выращивания (в теплицах, парниках или же открытом грунте):
Кусты помидоров этого типа формируют в зависимости от способа выращивания (в теплицах, парниках или же открытом грунте):
- В 1 или в 2 стебля, если они растут на открытых незащищенных грядах. При этом в первом случае вырезают все пасынки, верхушку оставляют. При формировании помидор в два стебля 1-й пасынок не удаляют. Схема в 3 стебля на открытых грядах не применяется.
- В 3 стебля, если они растут в теплице. Обычно так формируют среднепоздние разновидности. На каждом кусте оставляют первые 2 пасынка, их укорачивают после образования на ней 1-й цветочной кисти, оставляя над ней по 1 листу.
- С переводом точки роста на боковой побег. Этот вариант рекомендуется для среднеранних разновидностей и гибридных помидоров. Процесс формирования выглядит так: дают расти 1-му пасынку, на нем должен появиться второй побег. На каждом из них сохраняют по 2-3 плодовых кистей, верхушки после них отрезают, оставляя по 1 листу над томатами. Все остальные отростки удаляют. Такой прием позволяет избежать вершкования главного стебля и получить дополнительно еще несколько соцветий.
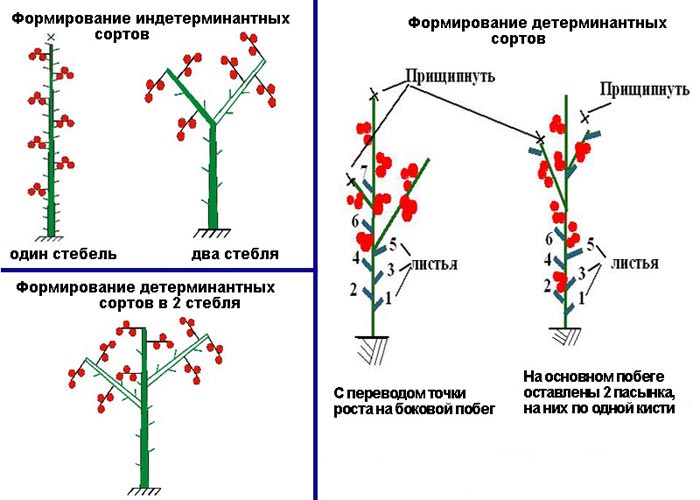
Последняя схема подходит для формирования детерминантных томатов в зимне-весеннем обороте в обогреваемых теплицах.
Супердетерминантных томатов
Это низкорослые раннеспелые сорта, с не более чем 3-мя соцветиями на побеге. Их формируют в 2 и 3 стебля, при этом схема формирования томатов в два стебля предпочтительна для грунтовых растений, в три – для тепличных. Разница между ними состоит еще и в том, что при первом способе на кустах будет меньшее количество плодов, но зато они будут крупнее.
Мнение эксперта
Мария Власова
Садовод-огородник
Задать вопрос экспертуФормирование помидор в личном хозяйстве не будет сложной задачей для овощевода, если знать, к какому типу они принадлежат. Нужно использовать рекомендуемые схемы, тогда удастся избежать возможных проблем и получить качественный и обильный урожай собственноручно выращенных плодов.
Нужно использовать рекомендуемые схемы, тогда удастся избежать возможных проблем и получить качественный и обильный урожай собственноручно выращенных плодов.
Формирование кустов томатов: пасынкование и прищипка помидоров
Большой урожай крупных помидоров без пасынкования и прищипки невозможен. Фото: Liz WestБольшой урожай крупных помидоров без пасынкования и прищипки невозможен. Фото: Liz WestКак и когда правильно прищипывать и пасынковать помидоры без ошибок, повышая урожайность. Пасынкование и прищипка, формирование куста томатов в картинках.
Текст: Майя Григоровская · 10-16-2014 12-15-2020 Good-Tips.PROУ томата генетически обусловлен огромный потенциал для формирования вегетативных органов. На его родине (Мексика, Перу), где особенно благоприятные условия для роста и развития растений, их выращивают как многолетние. Поэтому у растений быстро развиваются и созревают вегетативные почки. Благодаря этому за вегетационный период одно растение, кроме главного стебля, может образовать 150 и больше боковых побегов (пасынков) различного порядка. Чем больше побегов на растении, тем больше на нем цветочных кистей, формирующих плоды.
Чем больше побегов на растении, тем больше на нем цветочных кистей, формирующих плоды.
Есть научные данные о том, что при благоприятных условиях одно растение может сформировать до 250 плодов. Но в условиях конкуренции за питательные вещества, плоды медленно растут и еще медленнее созревают. Особенно это касается центральных и северных европейских регионов, где освещенность и температура в период вегетации ниже оптимума, необходимого для нормального развития и плодоношения томата. Здесь растения не могут обеспечить одновременно рост листьев и формирование большого количества плодов.
Такие вот кустики томатов. Источник: forums.gardenweb.comОптимальная температура для роста и развития растений томата в открытом грунте +22–24 °С, в закрытом — +24–31 °С. При температуре рост растений замедляется, а ниже +12 °С и выше +35 °С вообще прекращается. При температуре ниже +15 °С и выше +35 °С растения не цветут.
Кроме тепла, растения требовательны и к свету. Получить высокий урожай хорошего качества можно только с грядки, которая на протяжении всего дня освещается солнцем. Если растениям недостаточно света, они наращивают излишнюю вегетативную массу.
Если растениям недостаточно света, они наращивают излишнюю вегетативную массу.
Пасынкование — это искусственное удаление боковых побегов (пасынков), образующихся в пазухах листьев. Необходимость в этом агротехническом приеме возникает по ряду причин. В первую очередь, в связи с тем, что томат теплолюбивая культура, и чтобы плоды успели созреть в северных районах, необходимо регулировать нагрузку на куст.
Пасынок, требующий удаления. Источник: g.janecraft.netУстановлено, что в пропорциональном отношении корневая система у томата в 5 раз меньше надземной. Когда вегетативная масса растений значительно больше корневой, то рост и своевременное созревание плодов затруднено по ряду причин:
- На формирование одного листа затрачивается 1,5 г сухого вещества. Это соответствует третьей части сухого вещества, необходимого для формирования одного плода массой 80 г. Значит, сухое вещество, затраченное на развитие трех листьев, могло быть израсходованным на образование одного плода.

- При большом количестве пасынков и, следовательно, листьев, корень не может обеспечить листовой аппарат достаточным питанием, поэтому часть листьев желтеет и отмирает раньше времени, не успев принять участие в процессе ассимиляции веществ, необходимых для образования плодов.
- Большое количество листьев способствует чрезмерному загущению посадок, уменьшая тем самым доступ света и воздуха к растениям. А в таких посадках всегда есть риск заболевания растений.
Из приведенных выше фактов следует, что в зависимости от климатических условий в каждом конкретном случае необходимо разработать такую агротехнику, при которой каждый лист может работать продуктивно, обеспечивая образование достаточного количества цветочных кистей и плодов на них.
В зависимости от сорта, типа куста, степени ветвления растений определяются площадь питания, приемы агротехники и способы формирования куста. При одной и той же площади питания растений число боковых побегов (пасынков) у разных сортов может колебаться: от 5 до 15 второго; от 12 до 40 третьего; от 2 до 15 четвертого порядка. Чем больше площадь питания, тем больше пасынков развивается на растении и наоборот.
Чем больше площадь питания, тем больше пасынков развивается на растении и наоборот.
По характеру ветвления побегов растений томата, различают два типа куста: детерминантный и индетерминантный.
Детерминантный тип куста обычно бывает у скоро- и среднеспелых сортов. У сортов с детерминантным типом куста после образования 3–4 листьев на главном стебле закладывается соцветие — первая кисть. Вторая кисть образуется через 2— 3 листа; последующие — через 1 лист, а последние 2–3 кисти формируются подряд, ими обычно и заканчивается рост главного стебля.
Таким образом, соцветие ограничивает (детерминирует) рост главного побега. В пазухе каждого листа развиваются почки, из которых впоследствии образуются пасынки. Главный стебель растений детерминантных сортов низко- или среднерослый, достигает 30–65 см. На нем формируется от 2–3 до 4–5 соцветий
Схема пасынкования и прищипки кустов томатовУ индетерминантных сортов первое соцветие обычно закладывается над 9–12-м листом; последующие — через каждые 3, иногда 4 листа. Образование новых соцветий идет непрерывно, пока есть благоприятные условия. Поэтому стебель растений может достигать до 3 м в высоту. Такой тип куста присущ позднеспелым сортам томата. У них огромная потенциальная возможность образования пасынков, так как в каждой пазухе листа быстро развивается и созревает вегетативная почка.
Образование новых соцветий идет непрерывно, пока есть благоприятные условия. Поэтому стебель растений может достигать до 3 м в высоту. Такой тип куста присущ позднеспелым сортам томата. У них огромная потенциальная возможность образования пасынков, так как в каждой пазухе листа быстро развивается и созревает вегетативная почка.
В южных районах растения детерминантных и часто индетерминантных сортов дают полноценный урожай без пасынкования. В остальных регионах пасынкование — обязательное условие получения урожая. Если рост растений вовремя не ограничить, то осенние холода, излишняя влага и грибные болезни могут погубить урожай раньше, чем плоды успеют сформироваться и вызреть. Не исключено, что плоды томатов трескаются и погибают из-за избытка влаги. Возможно, прищипка и пасынкование ускорили бы на 1 —1,5 недели их созревание.
Детерминантные сорта обычно формируют в 2–3 стебля, то есть дают развиться, кроме главного, еще 1–2 боковым побегам. На главном стебле оставляют все сформировавшиеся кисти. Для формирования 2-го и 3-го побегов оставляют самые развитые пасынки. Остальные соцветия и побеги удаляют (пасынкуют) каждую неделю, по мере их появления.
Для формирования 2-го и 3-го побегов оставляют самые развитые пасынки. Остальные соцветия и побеги удаляют (пасынкуют) каждую неделю, по мере их появления.
Лучший эффект от пасынкования достигается, когда пасынки удаляют в фазе начала образования первого листа — они легко, с хрустом отламываются, если их пригнуть вниз. Если пасынки переросли эту фазу, их лучше осторожно срезать ножом, смоченным в 1%-ном растворе марганца.
Растения детерминантных и, особенно сверхранних, так называемых супердетерминантных сортов, можно также формировать в один стебель, по типу индетерминантных. Для продолжения роста главного стебля оставляют побег, появившийся в пазухе листа, расположенного ниже последней или предпоследней цветочной кисти. Все пасынки ниже его удаляют по мере их появления. Так же пасынкуют и побеги третьего порядка, появившиеся позже в пазухах листьев побега, оставленного для продолжения роста главного стебля.
При такой формировке томатного растения можно на 1–1,5 недели ускорить созревание плодов. Кроме того, значительно уменьшается риск заболевания растений, поскольку стебель и листья оказываются приподнятыми над землей, так как подвязаны к опоре.
Кроме того, значительно уменьшается риск заболевания растений, поскольку стебель и листья оказываются приподнятыми над землей, так как подвязаны к опоре.
Индетерминантные сорта обычно формируют в один, редко в два стебля. При формировке в один стебель оставляют практически только побеги, продолжающие рост главного стебля, а боковые пасынкуют, не давая им разрастись. На главном побеге (в зависимости от региона выращивания] оставляют 5 — 10 кистей, затем прищипывают верхушку побега над последней кистью, цветки которой уже раскрылись, оставляя выше нее 1–2 листа.
Как правильно пасынковать помидорыПрищипка — агротехнический прием, ограничивающий рост главного побега. Прищипывают верхушку побега только после того, как раскроются цветки верхнего соцветия. Над соцветием обязательно оставляют 1–2 листа. Они снабжают плоды питательными веществами.
При формировке в два стебля, кроме главного, дают развиться еще одному из боковых. На главном стебле оставляют на плодоношение 4–5 кистей, затем верхушку прищипывают. На пасынке оставляют 2–4 кисти и также прищипывают верхушку.
На пасынке оставляют 2–4 кисти и также прищипывают верхушку.
Естественно, формирование кустов томата невозможно без подвязки. Растения подвязывают шпагатом (восьмеркой) к кольям, шпалере или другим видам опор в течение всего периода вегетации. Кроме того, чтобы избежать застоя сырого воздуха в приземной зоне, нужно постепенно удалять нижние листья до первой плодоносящей кисти, а также все пожелтевшие листья. Эту операцию проводят раз в неделю, убирая одновременно не более 2–3 листьев.
Напомним, что томат нуждается в минеральных элементах питания. В отличие от других культур, его растения в первую очередь извлекают из почвы калий, затем азот. Но особое место в пищевом режиме томата занимает фосфор, которому принадлежит исключительная роль в плодообразовании.
У этих томатов с питанием все отлично. Фото: lomomarket.comУстановлено, что из 100% фосфорной кислоты, извлеченной растениями из почвы, — 94% приходится на долю плодов и лишь 6% на долю побегов и листьев. Поэтому очень важно подкормить растения фосфорными удобрениями в начале фазы образования плодов.
У томата большая листовая поверхность, с которой испаряется большое количество воды, значит, он нуждается в постоянном ее пополнении. Однако нельзя забывать и о том, что томат не любит повышенной влажности воздуха. Поэтому категорически не рекомендуются поливы методом дождевания.
При сухой и жаркой погоде растения поливают не менее двух раз в неделю подогретой на солнце водой. Сделав небольшое углубление в междурядье, воду (1 ведро на растение) выливают непосредственно под корень, стараясь не намочить листья. Когда вода впитается, углубление присыпают сухой почвой (мульчируют).
В дождливую погоду нужно использовать малейшую возможность, чтобы глубоко разрыхлить почву. Это способствует быстрому испарению излишней влаги.
Обновление: рекомендуем почитать про мини-шпалеры для томатов и сладких перцев (гибрид колышка и шпалерной сетки).
Frontiers | Профилирование транскриптома томатов раскрывает участие цитохрома P450 и пероксидаз в формировании цвета стигмы
Введение
Опыление — решающее событие в половом размножении, которое поддерживает жизненный цикл цветущих растений на поверхности земли. Клеймо, которое функционирует как реципиент пыльцы, имеет широкую вариацию окраски, как и цветы. Разная окраска цветков и рыльц объясняется накоплением различных пигментов, которые могут привлекать определенных опылителей для облегчения опыления.Например, у некоторых видов, таких как Arabidopsis и помидор ( Solanum lycopersicum ), рыльца окрашены в зеленый цвет, а у огурца ( Cucumis sativus L.) — желтый. Кроме того, цвет рыльца часто рассматривается как важный признак при идентификации сорта некоторых сельскохозяйственных культур, таких как рис ( Oryza sativa ). Например, у многих сортов риса в Азии рыльца бесцветные, но в большинстве диких зародышевых зародышей они окрашены, что означает их участие в процессе приручения (Han et al., 2006). На данный момент обширные исследования подтвердили, что окраска цветов обусловлена в основном флавоноидами, каротиноидами и беталаинами, в которых флавоноиды являются наиболее важными (Grotewold, 2006; Tanaka and Brugliera, 2013; Gao et al.
Клеймо, которое функционирует как реципиент пыльцы, имеет широкую вариацию окраски, как и цветы. Разная окраска цветков и рыльц объясняется накоплением различных пигментов, которые могут привлекать определенных опылителей для облегчения опыления.Например, у некоторых видов, таких как Arabidopsis и помидор ( Solanum lycopersicum ), рыльца окрашены в зеленый цвет, а у огурца ( Cucumis sativus L.) — желтый. Кроме того, цвет рыльца часто рассматривается как важный признак при идентификации сорта некоторых сельскохозяйственных культур, таких как рис ( Oryza sativa ). Например, у многих сортов риса в Азии рыльца бесцветные, но в большинстве диких зародышевых зародышей они окрашены, что означает их участие в процессе приручения (Han et al., 2006). На данный момент обширные исследования подтвердили, что окраска цветов обусловлена в основном флавоноидами, каротиноидами и беталаинами, в которых флавоноиды являются наиболее важными (Grotewold, 2006; Tanaka and Brugliera, 2013; Gao et al. , 2016). Однако мало что известно об участии пигментов, особенно флавоноидов, в формировании окраски рыльца.
, 2016). Однако мало что известно об участии пигментов, особенно флавоноидов, в формировании окраски рыльца.
Флавоноиды, большая группа полифенолов растений, широко распространена в растительном мире. К настоящему времени у растений идентифицировано более 10 000 структур флавоноидов (Julkunen-Tiitto et al., 2015). Это разнообразие возникает из-за комбинаторных модификаций основного флавоноидного каркаса путем декорирования ферментов, таких как гликозил, ацил и метилтрансферазы, а также из-за структурных различий в основном флавоноидном скелете, таком как изофлавоноиды (Mehrtens et al., 2005). Помимо функций цветочных пигментов, флавоноиды играют важную роль во многих других аспектах роста растений, развития и реакции на раздражители окружающей среды, таких как регулирование транспорта ауксина, мужская фертильность, опыление, устойчивость к патогенам и защита от УФ-излучения (Harborne и Williams, 2000; Zhang et al., 2015). Кроме того, флавоноиды являются хорошими антиоксидантами и, как было продемонстрировано, способствуют укреплению здоровья человека и снижают основной фактор риска некоторых заболеваний при употреблении в пищу растительного происхождения (Hannum, 2004; Hooper and Cassidy, 2006; Tapas et al., 2008; Martin et al. др., 2011; Ли и др., 2015). Флавоноиды можно разделить на различные подгруппы: халконы, флавоны, флавонолы, флаваноны, изофлавоны, флаванолы и антоцианы, в которых халконы функционируют как желтые пигменты во многих цветках, антоцианы обычно имеют красный, фиолетовый и синий цвета, а некоторые из них другие классы, такие как флавонолы и флаванолы, служат в качестве дополнительных пигментов (Tanaka et al., 2008; Петрусса и др., 2013).
Путь биосинтеза флавоноидов хорошо изучен (рис. 1), и он сохраняется среди семенных растений (Tanaka et al., 2008; Buer et al., 2010; Petrussa et al., 2013; Saito et al., 2013; Вестон и Матесиус, 2013). Флавоноиды биосинтезируются по общему фенилпропаноидному пути в цитозоле (Winkel, 2004). Предыдущие исследования показали, что ферменты, участвующие в пути биосинтеза, образуют мультиферментный комплекс (метаболон) посредством межбелкового взаимодействия и связываются с мембраной ER (Grotewold, 2006; Ono et al., 2006; Kuhn et al., 2011). Эти ферменты принадлежат к нескольким семействам ферментов, таким как цитохром-P450, OGD и GT (Tanaka, 2006; Tanaka et al., 2008). Гены, кодирующие эти биосинтетические ферменты пути, такие как CHS, CHI, F3’H, F3’5’H, FLS, DFR, ANS, 3GT , флавоноид 3- O -глюкозид-рамнозилтрансфераза ( RT ) и 5GT были клонированы и проанализированы на различных видах растений (Shirley et al., 1995; Pourcel et al., 2005; Buer et al., 2007; Owens et al., 2008а, б; Буэр и Джорджевич, 2009; Falcone Ferreyra et al., 2015). Помимо этих биосинтетических генов, комбинации факторов R2R3-MYB, bHLH и WDR и их взаимодействия также участвуют в регуляции биосинтеза флавоноидов на уровне транскрипции. Эта модель была хорошо изучена для Arabidopsis , томатов, кукурузы ( Zea mays ), петуний ( Petunia hybrida ) и некоторых других растений (Koes et al., 2005; Ramsay and Glover, 2005; Morita et al., 2006; Gonzali et al., 2009; Xu et al., 2015). Факторы транскрипции MYB и bHLH (TF) являются самыми крупными семействами среди растительных TF и обнаруживаются у всех эукариот (Heim et al., 2003; Dubos et al., 2010; Feller et al., 2011), тогда как белки WDR являются плейотропными, которые участвуют во множественных процессах, таких как биосинтез флавоноидов, судьба множества эпидермальных клеток и формирование трихомов и корневых волосков (Tanaka et al., 2008; Li et al., 2014). Интересно, что эти три белка могут образовывать тройной комплекс, называемый MBW (MYB-bHLH-WDR) (Baudry et al., 2004). Считается, что комплекс MBW непосредственно отвечает за активацию экспрессии флавоноидных LBG (Gonzalez et al., 2008; Thevenin et al., 2012; Xu et al., 2014, 2015).
РИСУНОК 1. Упрощенный обзор пути биосинтеза флавоноидов в томате. PAL, фенилаланин-аммиак-лиаза; C4H, циннамат-4-гидроксилаза; 4CL, 4-кумарат: КоА-лигаза; CHS, халкон-синтаза; CHI, халконизомераза; F3H, флаванон-3-гидроксилаза; F3’H, флавоноид-3′-гидроксилаза; F3’5’H, флавоноид-3 ‘, 5’-гидроксилаза; FLS, флавонолсинтаза; DFR, дигидрофлавонолредуктаза; ANS, антоцианидинсинтаза; 3GT, флавоноид-3-O -глюкозилтрансфераза; RT, флавоноид 3-O -глюкозид-рамнозилтрансфераза; AAC, антоцианинацилтрансфераза; 5GT, флавоноид-5-глюкозилтрансфераза.
Помидоры широко выращиваются как важная овощная культура во всем мире. Хотя путь биосинтеза флавоноидов хорошо известен у томатов (Ye et al., 2015), большинство исследований сосредоточено на регулируемом флавоноидами цветообразовании плодов томата. До сих пор в плодах томатов было идентифицировано около 70 флавоноидов, которые преимущественно накапливаются в кожуре плодов (Bovy et al., 2002; Colliver et al., 2002; Iijima et al., 2008; Ballester et al., 2010). .Основными флавоноидами в плодах томатов являются халкон нарингенина, кверцетин, кемпферол и их конъюгированные формы, такие как различные гликозиды (Moco et al., 2006). Среди них халкон нарингенина желтого цвета, один из самых распространенных флавоноидов в плодах томатов, накапливается в кутикуле во время созревания плода и, таким образом, определяет желтый цвет кожуры на стадии разрушения. Кроме того, кверцетин-3-рутинозид (рутин) и кемпферол-3-рутинозид также распределяются в кожуре спелых плодов (Ballester et al., 2010).
Несмотря на важность стигмы как важнейшей структуры женского репродуктивного органа, мало что известно о механизме регуляции цвета рыльца у растений. Более того, насколько нам известно, не существует идентифицированных мутантов томатов с разным цветом рыльц. В этом исследовании с помощью мутагенеза EMS мы идентифицировали мутант с необычной желтой окраской стигмы. Этот мутант получил название ys . Мы исследовали содержание пигментов в рыльцах мутанта ys и WT (зеленое клеймо), а также провели сравнительный анализ профилей транскриптомов для выяснения генов и генных сетей, участвующих в формировании желтых рыльцев у томатов.Наше исследование показало, что накопление желтого флавоноида нарингенина халкона было значительно увеличено в желтой стигме и двух генах цитохрома P450, SlC3h2 и SlC3h3 , которые кодируют p -кумарат 3-гидроксилазы, и шесть генов POD м. участвовать в формировании желтой стигмы посредством непрямой регуляции уровня халкона нарингенина у мутанта ys . Эти результаты предоставляют ценную информацию для анализа молекулярного механизма образования желтого рыльца у томатов.
Материалы и методы
Растительные материалы и условия роста
Мутант томата ys был получен на фоне инбредной линии TTD302A посредством EMS-мутагенеза с использованием метода Сайто (Saito et al., 2011) и стабилизирован посредством шести поколений самоопыления до этого исследования. Семена мутанта ys и WT проращивали на влажной фильтровальной бумаге в чашке Петри при 28 ° C в темноте в течение 3 дней. Затем полученные проростки выращивали в камере для выращивания при фотопериоде 16 часов / 8 часов (свет / темнота) при температурах 25/16 ° C соответственно.После четырех стадий появления настоящих листьев растения были перенесены в теплицу на экспериментальном поле Северо-Западного университета A&F. Борьба с вредителями и управление водными ресурсами проводились в соответствии со стандартными методами.
Измерение уровней хлорофилла, каротиноидов и флавоноидов
Свежие рыльца на стадии цветения собирали у WT и мутанта ys в одно и то же время в один и тот же день, а затем немедленно использовали для измерения пигментации. Общие хлорофиллы и каротиноиды экстрагировали и количественно оценивали спектрофотометрическим методом, как описано ранее (Lichtenthaler, 1987; Bou-Torrent et al., 2015).
Экстракция и анализ флавоноидов и других полифенолов выполнялись согласно Bino et al. (2005) с некоторыми модификациями. 100 мг замороженного порошка рыльцев томатов экстрагировали 80% метанолом в течение 12 часов при 4 ° C с последующей 30-минутной обработкой ультразвуком. Затем смеси центрифугировали при 12000 об / мин в течение 10 минут при 4 ° C и супернатанты фильтровали (0,2 мкм). Экстракцию повторяли один раз указанным выше способом. Образцы анализировали и идентифицировали с использованием системы ВЭЖХ Waters Alliance 2695 HT, соединенной с масс-спектрометром Q-TOF (Waters-Micromass, Милфорд, Массачусетс, США).20 мкл экстракта пробы вводили и разделяли с использованием аналитической колонки с обращенной фазой Luna C18 (3 мкм, 150 мм × 2,1 мм; Phenomenex) при 40 ° C и градиенте 5–50% ацетонитрила в 0,1% муравьиной кислоте при температуре расход 0,3 мл мин. -1 . Элюированные соединения детектировали при 200–600 нм с использованием детектора 996 PDA (Waters, Milford, MA, США), а затем масс-спектрометра, оборудованного источником ионизации электрораспылением (ESI). Условия проведения ЖХ-МС были следующими: температура десольватации составляла 250 ° C при скорости потока газообразного азота 10 л мин. -1 и капиллярное напряжение 3 кВ; исходная температура составляла 120 ° C; конусное напряжение составляло 35 эВ при потоке газа 1 л мин. -1 , а энергия столкновения составляла 5 эВ в режиме положительных ионов или 10 эВ в режиме ионов.Ионы в диапазоне m / z 100–1500 регистрировались с использованием времени сканирования 0,9 с и задержки между сканированием 0,1 с. Флавоноидные соединения и другие полифенолы были идентифицированы с использованием времени удерживания, полученного с помощью аутентичных стандартов, и массы, рассчитанной для иона ( M + H ) + (дополнительная таблица S1), и количественно определены путем сравнения площади каждого отдельного пика с стандартные кривые, полученные для чистых соединений. Все измерения повторяли с тремя независимыми биологическими образцами, и каждый образец анализировали в трех экземплярах.
Определение содержания лигнина
Рыльца на стадии цветения от WT и ys мутанта собирали и лиофилизировали в жидком азоте. Содержание лигнина определяли ацетилбромидным методом, как описано ранее с некоторыми модификациями (Yan et al., 2012). Образцы измельчали в порошок, затем 10 мг порошка промывали четыре раза 95% этанолом и дважды смесью 100% этанола и н -гексана (1: 2 по объему). Осадок собирали, сушили при 60 ° C и затем суспендировали в 2 мл 25% ацетилбромида в ледяной уксусной кислоте.После инкубации при 70 ° C в течение 30 минут добавляли 0,9 мл 2 M NaOH, затем 2 мл ледяной уксусной кислоты и 0,1 мл 7,5 M гидрохлорида гидроксиламина. Смесь центрифугировали при 4500 об / мин в течение 5 минут и собирали супернатант, затем измеряли оптическую плотность при 280 нм. Содержание лигнина выражали как абсорбция 280 в пересчете на свежий вес. Все измерения проводились с тремя биологическими образцами, и каждый образец анализировали в трех экземплярах.
Конструирование и секвенирование библиотеки дифференциальной экспрессии генов (DGE)
Молодые рыльца длиной около 1 мм были собраны у мутантов WT и ys в одно и то же время в один и тот же день.Образцы немедленно замораживали в жидком азоте и хранили при -80 ° C для анализа RNA-Seq. Тотальную РНК выделяли с помощью набора для экстракции РНК (Promega, США). Качество РНК проверяли электрофорезом в агарозном геле без РНКазы, чтобы избежать возможной деградации и загрязнения, а затем проверяли с помощью биоанализатора Agilent 2100 (Agilent Technologies, Санта-Клара, Калифорния, США). Затем мРНК Poly (A) выделяли с использованием шариков олиго-dT (Qiagen, Германия), а затем разбивали на короткие фрагменты, добавляя буфер для фрагментации.КДНК первой цепи синтезировали с использованием случайной обратной транскрипции с гексамерным праймером с последующим синтезом кДНК второй цепи с использованием РНКазы H и ДНК-полимеразы I. Фрагменты кДНК очищали с использованием набора для быстрой ПЦР-экстракции QIA, а затем промывали EB буфер для добавления поли (A) репарации конца и лигирования к адаптерам секвенирования. После электрофореза в агарозном геле и экстракции кДНК из гелей фрагменты кДНК очищали и обогащали с помощью ПЦР для создания конечной библиотеки кДНК, которую затем секвенировали на платформе секвенирования Illumina (Illumina HiSeq TM 2500) с использованием технологии парных концов. .Были выполнены три биологических повтора для каждой линии от мутантов WT и ys, таким образом, были созданы и секвенированы шесть библиотек DGE.
Биоинформатический анализ данных DGE
Необработанные чтения были отфильтрованы для удаления последовательностей низкого качества (более 50% оснований с качеством ниже 20 в одной последовательности), чтения с более чем 5% N оснований (базы неизвестны) и чтения, содержащие последовательности адаптеров, с помощью программы Perl. Затем чистые чтения были сопоставлены с эталонным геномом томата с помощью TopHat2 (Consortium, 2012; Kim D.et al., 2013), допускающую до одного несоответствия. Унигены, картированные по крайней мере одним считыванием, по крайней мере в одном образце, были идентифицированы для дальнейшего анализа. ДЭГ были идентифицированы с помощью пакета R edgeR (Robinson et al., 2010). Уровень экспрессии каждого унигена был рассчитан и нормализован к FPKM. FDR использовался для определения порогового значения P-значения в нескольких тестах. В нашем исследовании FDR <0,05 и кратное изменение> 2 использовались в качестве пороговых значений различий в экспрессии генов.
Данные секвенированиябыли депонированы в базу данных Short Read Archive (SRA) в Национальном центре биотехнологической информации (NCBI) под регистрационным номером SRP080654.
Далее, DEG использовали для анализов обогащения GO и KEGG согласно Zhang et al. (2013). Термины GO с скорректированным значением P <0,05 и пути KEGG с значением P <0,05 считались значительно обогащенными дифференциально экспрессируемыми генами.
Проверка количественной ПЦР в реальном времени (qRT-PCR)
Количественные ПЦР-анализы в реальном времени проводили с использованием независимых рыльц томатов на той же стадии развития, что и те, которые использовались для анализа DGE. Тотальную РНК выделяли с помощью набора для экстракции РНК (Promega, США), а кДНК синтезировали с помощью обратной транскриптазы MultiScribe (Applied Biosystems, США).qRT-PCR проводили с использованием SYBR ® Premix Ex Taq TM от TaKaRa (Китай) на системе ПЦР в реальном времени Applied Biosystems 7500 (Applied Biosystems, США). Ген EF-1α томата использовали в качестве контрольного гена для нормализации данных экспрессии. Каждый эксперимент qRT-PCR повторяли с тремя биологическими образцами, и каждый образец анализировали в трех экземплярах. Относительную экспрессию генов рассчитывали с использованием метода 2 -ΔΔ C t , и стандартную ошибку рассчитывали между тремя биологическими повторностями.Специфичные для генов праймеры для qRT-PCR перечислены в дополнительной таблице S2.
Результаты
Накопление специфических флавоноидов является ответственным за фенотип желтой стигмы у мутанта ys
В то время как растение томата WT характеризовалось типичной зеленой стигмой, мутант ys , полученный посредством мутагенеза EMS, показал необычный фенотип «желтой стигмы» (Рисунки 2A – C). Примечательно, что эта разница в цвете стигмы между WT и мутантом ys была очевидна даже на очень ранней стадии развития стигмы (длина стигмы около 1 мм) (Рисунок 2D).
РИСУНОК 2. Морфологическая характеристика фенотипа желтой стигмы у мутанта ys . (A, B) Фенотип цветков после удаления лепестков и тычинок у WT (A) и ys мутанта (B) . (C) Стигмы WT или ys мутантных цветков на стадии цветения. (D) Молодые рыльца (длиной около 1 мм) у мутанта WT или ys . Штанга = 2 мм (A, B) и 1 мм (C, D) .
Чтобы изучить важные пигменты, ответственные за фенотип «желтого клейма», мы количественно оценили содержание хлорофиллов, каротиноидов и флавоноидов в рыльцах WT и мутанта ys на стадии цветения. К нашему удивлению, не было замечено никаких значительных изменений в уровнях общего хлорофилла и каротиноидов между диким животным и мутантом ys (рис. 3A и дополнительная таблица S3). Однако были обнаружены заметные различия в содержании некоторых полифенолов в пути биосинтеза флавоноидов.Например, желтое клеймо увеличивало в 4,3 и 8,9 раза p -кумаровой кислоты и халкона нарингенина соответственно. Однако уровни кемпферол-3-рутинозида и кверцетин-3-рутинозида (рутина) в рыльцах не изменились между диким животным и мутантом ys (фигура 3B и дополнительная таблица S3). Стоит упомянуть, что p -куаровая кислота является биосинтетическим предшественником халкона нарингенина (рис.1) (Petrussa et al., 2013; Saito et al., 2013; Falcone Ferreyra et al., 2015). Следовательно, весьма вероятно, что более высокое накопление p -кумариновой кислоты в мутанте ys привело к увеличению уровня халкона нарингенина. Эти результаты предполагают, что повышенное накопление желтого флавоноида нарингенина халкона может быть ответственным за фенотип желтой стигмы у мутанта ys .
РИСУНОК 3. Накопление пигментов в рыльцах на стадии цветения у WT и ys мутанта . (A) Общие уровни хлорофилла и каротиноидов в рыльцах WT и мутанта ys . (B) Уровни флавоноидов в рыльцах WT и ys мутанта . Значения представляют собой средние значения ± стандартная ошибка для трех биологических повторов ( n = 3). Звездочки указывают на существенные различия ( P <0,01) между WT и мутантом ys , определенные с помощью теста Дункана.
Идентификация дифференциально экспрессируемых генов (DEG) стигм от WT и ys Мутант
Чтобы идентифицировать гены и генные сети, которые участвуют в формировании желтой стигмы у томатов, мы выполнили анализ экспрессии по всему геному для сравнения профилей транскриптомов стигм между WT и мутантом ys с помощью подхода DGE (Eveland et al., 2010). Учитывая, что фенотипические изменения произошли на ранней стадии (рис. 2D), мы выбрали молодые рыльца (длиной около 1 мм) для анализа RNA-Seq. В этом проекте было сгенерировано 42,3–50,8 миллиона необработанных операций чтения из каждой библиотеки DGE. После удаления последовательностей адаптера и считывания низкого качества мы получили 41,8–50,1 млн чистых считываний высокого качества с общим количеством 5,2–6,3 млрд нуклеотидов. Среди этих чистых считываний процент Q20 (базовое качество более 20) и GC составил 94,4–94,8% и 42,8–43,0%, соответственно (дополнительный рисунок S1 и таблица S4).Кроме того, мы сгруппировали чистые чтения в уникальные чтения, которые были сопоставлены с геномом томата с помощью TopHat2 (Consortium, 2012; Kim D. et al., 2013). В шести библиотеках DGE около 91,2–92,9% чистых считываний из данных RNA-Seq были картированы однозначно в геном томата (дополнительная таблица S4).
На основании глубокого секвенирования во всех библиотеках было обнаружено 23 978 генов (дополнительная таблица S5). Мы использовали R-пакет edgeR для идентификации DEG (Робинсон и др., 2010). Уровень экспрессии каждого гена был нормализован до FPKM.Используя FDR <0,05 и кратное изменение> 2 в качестве пороговых значений значимости, мы получили 507 DEG, в которых 84 гена были значительно активированы, а 423 гена были значительно подавлены в стигмах мутанта ys по сравнению с таковыми. растений WT (дополнительная таблица S6). Чтобы проверить данные RNA-Seq, мы выполнили тесты qRT-PCR с использованием независимых рыльц томатов на той же стадии развития, что и те, которые использовались для анализа DGE. Шестнадцать DEG, включая 6 генов с повышенной регуляцией и 10 генов с пониженной регуляцией, были случайным образом выбраны для анализа qRT-PCR.Как показано в таблице 1, данные qRT-PCR полностью согласуются с данными RNA-Seq с точки зрения относительного кратного изменения экспрессии этих 16 генов между WT и мутантом ys (коэффициент корреляции Пирсона 0,969, P = 6,3E — 10), что свидетельствует о высокой надежности результатов RNA-Seq.
ТАБЛИЦА 1. qRT-PCR проверка дифференциально экспрессируемых генов, идентифицированных с помощью RNA-Seq.
Цитохром P450 и пероксидазы участвуют в формировании желтой стигмы у томатов
Чтобы понять профили экспрессии и потенциальные функции DEG, идентифицированных с помощью DGE, анализ обогащения по термину GO (исправлено P -значение <0.05). ДЭГ были разделены на категории клеточного компонента, биологического процесса и молекулярной функции (дополнительная таблица S7). Как показано на рисунке 4, в категории клеточного компонента была только одна группа «внеклеточная область» ( P = 8,8E-09). Термины GO катаболических и метаболических процессов были в основном обогащены в группе биологических процессов. В категории «молекулярная функция» тремя наиболее значительными обогащенными терминами GO были «оксидоредуктазная активность» ( P = 1.7E-11), «связывание гема» ( P = 1,7E-08) и «связывание ионов железа» ( P = 3,0E-08). Интересно, что все эти три группы имеют 23 общих гена, кодирующих цитохром P450 (CYP450), большое семейство ферментов, которые играют решающую роль в биосинтезе флавоноидов, отвечающих за окраску цветов (Tanaka, 2006; Tanaka and Brugliera, 2013), и 10 генов, кодирующих POD (дополнительная таблица S7), однако большинство этих генов подавлялись в стигмах мутанта ys по сравнению с WT (таблица 2).Например, уровни экспрессии двух генов CYP450 , Solyc10g078220 и Solyc10g078230 и двух генов POD , Solyc07g017880 и Solyc02g017880 и Solyc02.9-084790 снизились. соответственно, у мутанта ys по сравнению с таковым в WT, и проверка qRT-PCR выявила тот же паттерн экспрессии (Таблица 1). Эти данные показали, что цитохром P450 и POD могут играть важную роль в формировании желтого рыльца у томатов.
РИСУНОК 4. Термины GO, которые были значительно обогащены DEG между WT и ys мутантной стигмой. Результаты были суммированы по трем основным категориям: биологический процесс (BP, синий), молекулярная функция (MF, зеленый) и клеточный компонент (CC, оранжевый). Условия GO были отсортированы на основе скорректированного значения P , а скорректированное значение P <0,05 использовалось в качестве порогового значения.
ТАБЛИЦА 2. Список дифференциально экспрессируемых генов цитохрома P450 и POD, идентифицированных с помощью DGE на стигмах мутанта ys и WT.
Два гена цитохрома P450 и шесть генов пероксидазы могут действовать как отрицательные регуляторы образования желтой стигмы у помидоров
Для дальнейшей идентификации биологических путей, ответственных за формирование желтого рыльца у томатов, мы картировали обнаруженные DEG, чтобы ссылаться на канонические пути в KEGG (Kanehisa et al., 2004), а затем сравнили их с фоном всего транскриптома с поиск генов, участвующих в метаболических путях или путях передачи сигналов, которые были значительно обогащены.Используя значение P <0,05 в качестве порогового значения значимости, 29 DEG, включая 3 гена с повышенной и 26 пониженной регуляции, были отнесены к 8 путям KEGG (дополнительная таблица S8). Среди них «Биосинтез фенилпропаноидов» ( P = 1,4E-03), «Биосинтез вторичных метаболитов» ( P = 6,5E-03) и «Биосинтез ненасыщенных жирных кислот» ( P = 1,7E. — 02) были тремя главными значительно обогащенными путями KEGG (Рисунок 5). Однако путь «биосинтеза флавоноидов» ( P = 4.4E — 02), который предположительно был связан с фенотипом желтой стигмы у мутанта ys (рис. 3B), также был обогащен, несмотря на то, что значение P было выше. Следует отметить, что два CYP450 генов ( Solyc10g078220 и Solyc10g078230 ) и шесть СТРУЧОК генов ( Solyc07g017880, Solyc02g084790, Solyc10g076240, Solyc03g006700, Solyc02g079500 и Solyc04g071890 ), чьи выражения резко вниз регулируется в stigma мутанта ys (таблица 2) были картированы в «биосинтез фенилпропаноидов» и «биосинтез вторичных метаболитов» (дополнительная таблица S8).Более того, два гена CYP450 также участвовали в пути «биосинтеза флавоноидов» (дополнительная таблица S8). В этих путях два гена CYP450 кодируют C3H, которые катализируют p -куаровую кислоту, p -кумароил-КоА и p -кумаральдегид в кофейную кислоту, кофеил-CoA и кофеил-альдегид соответственно (рис. 6 и дополнительный рисунок S2) (Xue et al., 2014; Fornaléa et al., 2015), поэтому мы назвали эти два гена SlC3h2 ( Solyc10g078220 ) и SlC3h3 ( Solyc10g078230 ).Кроме того, шесть генов POD участвовали в последней стадии биосинтеза лигнина, нерастворимого полимера, связанного с клеточной стенкой (рис. 6) (Quiroga et al., 2000; Higuchi, 2006).
РИСУНОК 5. Значительно обогащенные пути KEGG в DEG. Пути KEGG были отсортированы на основе значения P , а значение P <0,05 использовалось в качестве порогового значения.
РИСУНОК 6. График KEGG пути биосинтеза фенилпропаноидов.Гены с пониженной регуляцией и неизмененные гены показаны в зеленых и черных прямоугольниках соответственно. «1.14.13.–» в зеленых прямоугольниках обозначают два гена цитохрома P450: SlC3h2 ( Solyc10g078220 ) и SlC3h3 ( Solyc10g078230 ). «1.11.1.7» в зеленых прямоугольниках представляют шесть генов POD ( Solyc07g017880, Solyc02g084790, Solyc10g076240, Solyc03g006700, Solyc02g079500, Solyc04g071890 ).
Стоит упомянуть, что p -кумаровая кислота действует как общий предшественник как для биосинтеза флавоноидов, так и для биосинтеза лигнина, а C3H и POD являются двумя ключевыми ферментами в пути биосинтеза лигнина (Higuchi, 2006; van der Rest et al., 2006; Петрусса и др., 2013; Renault et al., 2017). Учитывая репрессию двух SlC3H и шести POD с желтой меткой у мутанта ys (таблица 2), мы предположили, что более высокое накопление p -кумаровой кислоты у мутанта ys (рисунок 3B) может быть результатом сниженного биосинтеза лигнина. Чтобы проверить эту гипотезу, мы сравнили уровни кофейной кислоты, последующее производство p -кумаровой кислоты, катализируемое C3H, а также биосинтетический предшественник лигнина (рисунок 6) (Higuchi, 2006; Renault et al., 2017) и лигнин в рыльцах на стадии цветения между WT и мутантом ys . Как и ожидалось, содержание кофейной кислоты и лигнина было снижено в 7,6 и 8,5 раз в мутанте ys по сравнению с таковым у WT, соответственно (Рисунок 7 и Дополнительная таблица S3), что позволяет предположить, что сниженная экспрессия двух SlC3Hs и шесть POD могут ингибировать биосинтез лигнина, приводя к изменению направления метаболического потока p -кумаровой кислоты от лигнина к пути биосинтеза флавоноидов, что в конечном итоге привело к более высокому уровню халкона нарингенина (рис. 3B).Эти наблюдения показали, что два SlC3H и шесть POD могут действовать как негативные регуляторы в биосинтезе нарингенина халкона, что может играть положительную роль в формировании желтого рыльца у мутанта ys .
РИСУНОК 7. Содержание кофейной кислоты и лигнина в рыльцах на стадии цветения от WT и ys мутанта . Значения представляют собой средние значения ± стандартная ошибка для трех биологических повторов ( n = 3). Звездочками отмечены существенные различия ( P <0.01) между WT и мутантом ys , определенным с помощью теста Дункана.
Обсуждение
Мировая популярность томата как фруктового овоща обусловлена его уникальным вкусом и высокой питательной ценностью, которая в основном обеспечивается различными пигментами и вторичными метаболитами, такими как флавоноиды. Плоды томатов, которые при созревании проявляют разнообразную окраску, развиваются из цветочного органа, однако окраска различных частей цветка остается практически неизменной. Например, чашелистик, завязь, столбик и рыльце — зеленые, а лепесток и пыльник — все время желтые.Цвет цветков играет решающую роль в привлечении определенных опылителей для облегчения опыления, что важно для оплодотворения и последующего развития плодов. Поэтому важно лучше понимать механизмы пигментации различных частей цветка. Однако предыдущие исследования механизма регуляции пигментации у томатов в основном были сосредоточены на фруктах и редко — на цветках или рыльцах. В этом исследовании мы идентифицировали мутант ys с необычным фенотипом «желтая стигма» посредством мутагенеза EMS (рис. 2) (Saito et al., 2011). Это исследование обеспечивает полезную основу для понимания механизма регуляции пигментации стигмы томатов.
Хлорофиллы, каротиноиды и флавоноиды — три основных вида пигментов томатов (Ono et al., 2006; Tanaka and Brugliera, 2013). Цвет спелых плодов томатов в основном определяется каротиноидами и флавоноидами, за исключением конкретных генотипов (Ballester et al., 2010). В этом исследовании мы обнаружили, что хлорофиллы и флавоноиды преимущественно накапливаются в стигмах как WT, так и мутанта ys (дополнительная таблица S3), что позволяет предположить, что они играют важную роль в формировании окраски рыльца томатов.Эти наблюдения также указывают на существование как сходных, так и различных путей метаболизма пигментов между рыльцем томатов и фруктами, в то время как флавоноиды участвуют в обоих процессах. Кроме того, во время процесса созревания плодов томата нарингенин халкон, один из самых распространенных флавоноидов в кожуре плодов, отвечает за желтый цвет на стадии разрыва (Moco et al., 2006; Iijima et al., 2008; Ballester и др., 2010). Кроме того, измененный состав каротиноидов может также привести к желтому цвету фруктов (Ballester et al., 2010). И в стигме халкон нарингенина действует как активатор образования желтого стигмы из-за его значительно увеличенного содержания, обнаруженного у мутанта ys , но каротиноиды не влияют на цвет стигмы, потому что их накопление слишком мало и не меняется между WT. и ys (Рисунок 3 и дополнительная таблица S3), подтверждающие, что каротиноиды играют разные роли в желтых цветовых образованиях рыльца томатов и плодов, тогда как флавоноид нарингенин халкон является ключевым в этих двух процессах.
Лигнин, основной компонент вторичной клеточной стенки, может обеспечивать механическую прочность, а также защищать сосудистые растения от биотических и абиотических стрессов (Senthil-Kumar et al., 2010; Bi et al., 2011; Liu et al., 2016; Wang et al., 2017). Лигнин образуется посредством фенилпропаноидного пути и разделяет общие биосинтетические предшественники с флавоноидами, такие как фенилаланин, коричная кислота и p -кумариновая кислота (Higuchi, 2006; van der Rest et al., 2006; Petrussa et al., 2013; Renault et al., 2017). Снижение биосинтеза лигнина может повысить доступность этих предшественников и, таким образом, стимулировать выработку флавоноидных соединений. Например, повышающая регуляция циннамат-4-гидроксилазы (C4H), фермента, катализирующего синтез p -кумаровой кислоты из коричной кислоты, показывает противоположные эффекты на уровни стеблевого лигнина и фруктовых флавоноидов, особенно нарингенина и рутина (Millar и др., 2007). Снижение регуляции циннамоил-КоА редуктазы (CCR), ключевого фермента в образовании мономеров лигнина, приводит к снижению содержания лигнина и увеличению количества хлорогеновой кислоты, рутина и кемпферола рутинозида в томатах (van der Rest et al., 2006). И в этой статье с помощью RNA-Seq и биохимического анализа мы продемонстрировали репрессию C3H и POD, которые, как считается, необходимы для биосинтеза лигнина (Quiroga et al., 2000; Franke et al., 2002; Higuchi, 2006) , приводит к уменьшению накопления лигнина и увеличению уровней p -кумариновой кислоты и нарингенина халкона (рисунки 3, 7 и таблица 2), который имеет аналогичную модель взаимодействия между лигнином и флавоноидом, как и предыдущие исследования, но различные эффекты на соединения флавоноидов.
Фактически, роль гена C3H в метаболизме флавоноидов и окраске растений была подтверждена ранее. Например, C3Hs участвуют в биосинтезе хлорогеновой кислоты (Mahesh et al., 2007; Kim Y.B. et al., 2013). А репрессия C3Hs в Arabidopsis и кукурузе увеличивает накопление антоцианов, что приводит к пурпурной окраске их листьев (Abdulrazzak et al., 2006; Fornaléa et al., 2015). Более того, были проведены обширные исследования по регуляции генов POD в ответах растений на стресс, но об участии POD в контроле окраски растений никогда не сообщалось.Таким образом, наши результаты подтверждают теорию регуляции C3Hs в пути флавоноидов и предоставляют новую перспективу влияния C3Hs и POD на нарингениновый халкон, способствующий пожелтению окраски рыльца у помидоров. В настоящее время наше понимание биологических функций двух SlC3h2 и шести POD основано на биоинформатическом и биохимическом анализах, поэтому необходимо провести дальнейшие исследования для выяснения их конкретной роли в формировании окраски рыльца томатов путем экспрессии. анализ паттернов и изучение генетической трансформации (РНКи и сверхэкспрессия) в томате.Таким образом, наши данные предоставляют ценную информацию для дальнейшей функциональной характеристики фенотипа желтой стигмы.
Более того, регуляция транскрипции биосинтеза флавоноидов и лигнина контролируется некоторыми ключевыми TF в растениях. Например, R2R3-MYB, bHLH и WDR участвуют в пути биосинтеза флавоноидов (Xu et al., 2014, 2015), тогда как KNOX, HD-ZIP, NAC и R2R3-MYB участвуют в регуляции лигнина (Du et al. al., 2011; Xu et al., 2012; Townsley et al., 2013; Liu et al., 2015). Похоже, что факторы R2R3-MYB потенциально играют ключевую роль в обоих путях. Кроме того, некоторые члены этого семейства были признаны позитивными регуляторами биосинтеза флавоноидов. Например, AtMYB11, AtMYB12 и AtMYB111 в Arabidopsis могут активировать гены биосинтеза флавоноидов, а сверхэкспрессия AtMYB11 или AtMYB12 увеличивает содержание флавонолов (Mehrtens et al., 2005; Li et al., 2005; Li et al., 2015; Li et al. др., 2015). В томате нарушение регуляции экспрессии SlMYB12 приводит к снижению уровня нарингенина халкона, что приводит к розовому цвету плодов (Ballester et al., 2010). Более того, некоторые TF R2R3-MYB были идентифицированы как репрессоры пути биосинтеза лигнина. Например, ZmMYB31 и ZmMYB42 кукурузы подавляют несколько генов лигнина, тем самым снижая содержание лигнина, и этот эффект перенаправляет метаболический поток фенилпропаноидов на биосинтез флавоноидов (Sonbol et al., 2009; Fornale et al., 2010). И MYB от других видов, таких как львиный зев ( Antirrhinum majus ), просо ( Panicum virgatum ) и leucaena ( Leucaena leucocephala ), также могут ингибировать биосинтез лигнина (Liu et al., 2015). В нашем исследовании, учитывая заблокированный путь биосинтеза лигнина и повышенное накопление флавоноидов в стигме мутанта ys (рисунки 3B, 7), мы предполагаем, что сдвиг в профиле экспрессии C3Hs и POD также может быть регулируется ТФ R2R3-MYB, однако эту гипотезу необходимо подтвердить в будущем.
Кроме того, учитывая важность стигмы при опылении цветковых растений, мы попытались изучить влияние этой мутации окраски стигмы на репродуктивное развитие томатов, но, к сожалению, мы не обнаружили каких-либо существенных различий между WT и мутантом ys у с точки зрения восприимчивости стигмы, жизнеспособности пыльцы, опыления и завязывания плодов (данные не показаны).Тем не менее, открытие и описание фенотипа ys имеет важное научное и теоретическое значение для понимания механизма развития окраски стигмы томатов, о котором никогда не сообщалось до нашего исследования, и улучшения регуляции пигментации у растений томатов. Учитывая, что и флавоноиды, и лигнин играют важную роль в реакции растений на стресс окружающей среды (Senthil-Kumar et al., 2010; Petrussa et al., 2013; Zhang et al., 2015; Liu et al., 2016), их содержание изменены у мутанта ys по сравнению с таковыми у WT (рис. 3, 7), в будущей работе мы исследуем важность цвета стигмы с точки зрения взаимодействия между пигментами и факторами окружающей среды у томатов.
Авторские взносы
YZ и YaL разработали эксперименты, YZ, GZ, JZ и MS проводили эксперименты. YZ, GZ, YuL и TM проанализировали данные. YZ написал статью вместе с YaL. Все авторы рецензировали рукопись.
Финансирование
Эта работа была поддержана Национальной программой ключевых исследований и разработок Китая (2016YFD0101703) для YaL и Национальной программой ключевых исследований и разработок Китая (2016YFD0100204-30), Программой научных и технологических исследований и разработок провинции Шэньси (2015NY098) и Фонды фундаментальных исследований для Северо-Западного университета A&F (2452015024) — YZ.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарность
Мы благодарим сотрудников лаборатории Liang за полезные обсуждения и техническую помощь.
Сокращения
ANS, антоцианидинсинтаза; bHLH, основная спираль-петля-спираль; C3H, p -кумарат-3-гидроксилаза; CHI, халконизомераза; CHS, халкон-синтаза; ДЭГ, дифференциально экспрессируемый ген; DFR, дигидрофлавонолредуктаза; DGE, дифференциальная экспрессия гена; EMS, этилметансульфонат; ER, эндоплазматический ретикулум; FDR — коэффициент ложного обнаружения; F3’H, флавоноид-3′-гидроксилаза; F3’5’H, флавоноид-3 ‘, 5’-гидроксилаза; FLS, флавонолсинтаза; FPKM, количество фрагментов на килобазу экзона на миллион картированных фрагментов; FSII, флавон-синтаза II; GO, генная онтология; GT, глюкозилтрансферазы; 3GT, флавоноид-3-O -глюкозилтрансфераза; 5GT, флавоноид-5-глюкозилтрансфераза; ВЭЖХ, высокоэффективная жидкостная хроматография; KEGG, Киотская энциклопедия генов и геномов; LBG, гены позднего биосинтеза в пути биосинтеза флавоноидов; ЖХ-МС, жидкостный хроматограф-масс-спектрометр; OGD, 2-оксоглутарат-зависимые диоксигеназы; КПК, фотодиодная матрица; POD, пероксидаза; qRT-PCR, количественная ПЦР в реальном времени; RT, флавоноид 3-O -глюкозид-рамнозилтрансфераза; WDR, WD40-повтор; WT, дикий тип; лс, желтое клеймо .
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/article/10.3389/fpls.2017.00897/full#supplementary-material
Список литературы
Abdulrazzak, N., Pollet, B., Ehlting, J., Larsen, K., Asnaghi, C., Ronseau, S., et al. (2006). Мутант со вставкой кумароил-сложного эфира-3-гидроксилазы обнаруживает существование неизбыточных путей мета -гидроксилирования и важную роль фенольных предшественников в размножении клеток и росте растений. Plant Physiol. 140, 30–48. DOI: 10.1104 / стр.105.069690
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Баллестер, А. Р., Молтофф, Дж., Де Вос, Р., Хеккерт, Б., Орзаез, Д., Фернандес-Морено, Дж. П. и др. (2010). Биохимический и молекулярный анализ розовых томатов: нарушение регуляции экспрессии гена, кодирующего фактор транскрипции SlMYB12, приводит к окраске плодов розовых томатов. Plant Physiol. 152, 71–84. DOI: 10.1104 / стр.109.147322
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бодри, А., Heim, M.A., Dubreucq, B., Caboche, M., Weisshaar, B., and Lepiniec, L. (2004). TT2, TT8 и TTG1 синергетически определяют экспрессию BANYULS и биосинтез проантоцианидина в Arabidopsis thaliana . Завод J. 39, 366–380. DOI: 10.1111 / j.1365-313X.2004.02138.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Би К., Чен Ф., Джексон Л., Гилл Б. С. и Ли В. (2011). Экспрессия генов биосинтеза лигнина в пшенице во время развития и при заражении грибковыми патогенами. Завод Мол. Биол. Реп. 29, 149–161. DOI: 10.1007 / s11105-010-0219-8
CrossRef Полный текст | Google Scholar
Бино, Р. Дж., Де Вос, К. Х. Р., Либерман, М., Холл, Р. Д., Бови, А., Йонкер, Х. Х. и др. (2005). Свето-гиперчувствительная мутация томата с высоким содержанием пигмента-2 dg : изменения в метаболоме плода. New Phytol. 166, 427–438. DOI: 10.1111 / j.1469-8137.2005.01362.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Боу-Торрент, Дж., Толедо-Ортис, Г., Ортис-Алькаид, М., Сифуэнтес-Эскивель, Н., Халлидей, К. Дж., Мартинес-Гарсия, Дж. Ф. и др. (2015). Регулирование биосинтеза каротиноидов оттенком зависит от определенных подмножеств антагонистических факторов транскрипции и кофакторов. Plant Physiol. 169, 1584–1594. DOI: 10.1104 / стр.15.00552
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бови, А., де Вос, Р., Кемпер, М., Шейлен, Э., Альменар Пертехо, М., Мьюир, С. и др. (2002). Томаты с высоким содержанием флавонолов, полученные в результате гетерологичной экспрессии генов факторов транскрипции кукурузы LC и C1 . Растительная клетка 14, 2509–2526. DOI: 10.1105 / tpc.004218
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Буэр, К. С., Мудай, Г. К., и Джорджевич, М. А. (2007). Флавоноиды по-разному поглощаются и переносятся на большие расстояния в Arabidopsis . Plant Physiol. 145, 478–490. DOI: 10.1104 / стр.107.101824
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Колливер, С., Бови, А., Коллинз, Г., Мьюир, С., Робинсон, С., де Вос, К. Х. Р. и др. (2002). Повышение питательной ценности томатов за счет перепрограммирования пути их биосинтеза флавоноидов. Phytochem. Ред. 1, 113–123.
Google Scholar
Ду, Дж., Миура, Э., Робишон, М., Мартинес, К., и Грувер, А. (2011). Фактор транскрипции Populus Class III HD ZIP POPCORONA влияет на дифференцировку клеток во время вторичного роста древесных стеблей. PLoS ONE 6: e17458.DOI: 10.1371 / journal.pone.0017458
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дубос, К., Стракке, Р., Гротевольд, Э., Вайсхаар, Б., Мартин, К., и Лепиниц, Л. (2010). Факторы транскрипции MYB в Arabidopsis . Trends Plant Sci. 15, 573–581. DOI: 10.1016 / j.tplants.2010.06.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эвеланд, А. Л., Сато-Нагасава, Н., Гольдшмидт, А., Мейер, С., Битти, М., Sakai, H., et al. (2010). Цифровые сигнатуры экспрессии генов для развития кукурузы. Plant Physiol. 154, 1024–1039. DOI: 10.1104 / стр.110.159673
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фальконе Феррейра, М. Л., Эмилиани, Дж., Родригес, Э. Дж., Кампос-Бермудес, В. А., Гротевольд, Э., Касати, П. (2015). Идентификация кукурузы и Arabidopsis типа I FLAVONE SYNTHASE связывает флавоны с гормонами и биотическими взаимодействиями. Plant Physiol. 169, 1090–1107. DOI: 10.1104 / стр.15.00515
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Феллер А., Мачемер К., Браун Э. Л. и Гротевольд Э. (2011). Эволюционный и сравнительный анализ растительных факторов транскрипции MYB и bHLH. Plant J. 66, 94–116. DOI: 10.1111 / j.1365-313X.2010.04459.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Форнале, С., Ши, X., Чай, К., Энсина, А., Ирар, С., Капелладес, М., и другие. (2010). ZmMYB31 непосредственно репрессирует гены лигнина кукурузы и перенаправляет метаболический поток фенилпропаноидов. Plant J. 64, 633–644. DOI: 10.1111 / j.1365-313X.2010.04363.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Fornaléa, S., Rencoret, J., Garcia-Calvo, L., Capellades, M., Encina, A., Santiago, R., et al. (2015). Модификации клеточной стенки, вызванные подавлением кумарат-3-гидроксилазы-1 в кукурузе. Plant Sci. 236, 272–282.DOI: 10.1016 / j.plantsci.2015.04.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Franke, R., Humphreys, J. M., Hemm, M. R., Denault, J. W., Ruegger, M. O., Cusumano, J. C., et al. (2002). Ген Arabidopsis REF8 кодирует 3-гидроксилазу метаболизма фенилпропаноидов. Plant J. 30, 33–45. DOI: 10.1046 / j.1365-313X.2002.01266.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гао, Л., Ян, Х., Лю, Х., Янг, Дж., И Ху, Ю. (2016). Обширные изменения транскриптома, лежащие в основе вариации интенсивности окраски цветков у Paeonia ostii . Фронт. Plant Sci. 6: 1205. DOI: 10.3389 / fpls.2015.01205
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гонсалес А., Чжао М., Ливитт Дж. М. и Ллойд А. М. (2008). Регуляция пути биосинтеза антоцианов транскрипционным комплексом TTG1 / bHLH / Myb в проростках Arabidopsis . Завод Дж. 53, 814–827. DOI: 10.1111 / j.1365-313X.2007.03373.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хан, Л., Чжан, Т., Сюй, Дж., Ли, Й., Ван, X., и Ву, X. (2006). Генетический анализ и генное картирование пурпурной стигмы у риса. Acta Genet. Грех. 33, 642–646.
PubMed Аннотация | Google Scholar
Харборн, Дж. Б., и Уильямс, К. А. (2000). Успехи в исследованиях флавоноидов с 1992 года. Фитохимия 55, 481–504.
PubMed Аннотация | Google Scholar
Хайм М. А., Якоби М., Вербер М., Мартин К., Вайсхаар Б. и Бейли П. С. (2003). Основное семейство факторов транскрипции спираль-петля-спираль у растений: исследование структуры белка и функционального разнообразия в масштабах всего генома. Мол. Биол. Evol. 20, 735–747. DOI: 10.1093 / molbev / msg088
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хигучи, Т. (2006). Оглянитесь на исследования биохимии лигнина. J. Wood Sci. 52, 2–8. DOI: 10.1007 / s10086-005-0790-z
CrossRef Полный текст | Google Scholar
Хупер Л. и Кэссиди А. (2006). Обзор медицинского потенциала биологически активных соединений. J. Sci. Food Agric. 86, 1805–1813. DOI: 10.1002 / jsfa.2599
CrossRef Полный текст | Google Scholar
Иидзима, Ю., Накамура, Ю., Огата, Ю., Танака, К., Сакураи, Н., Суда, К. и др. (2008). Аннотации метаболитов, основанные на интеграции масс-спектральной информации. Plant J. 54, 949–962. DOI: 10.1111 / j.1365-313X.2008.03434.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Julkunen-Tiitto, R., Nenadis, N., Neugart, S., Robson, M., Agati, G., Vepsäläinen, J., et al. (2015). Оценка реакции растительных флавоноидов на УФ-излучение: обзор соответствующих методов. Phytochem. Ред. 14, 273–297. DOI: 10.1007 / s11101-014-9362-4
CrossRef Полный текст | Google Scholar
Канехиса, М., Гото, С., Кавасима, С., Окуно, Ю., и Хаттори, М. (2004). Ресурс KEGG для расшифровки генома. Nucleic Acids Res. 32, D277 – D280.
Google Scholar
Ким Д., Пертя Г., Трапнелл К., Пиментел Х., Келли Р. и Зальцберг С. Л. (2013). TopHat2: точное выравнивание транскриптомов при наличии вставок, делеций и слияний генов. Genome Biol. 14: R36. DOI: 10.1186 / GB-2013-14-4-r36
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ким Ю.Б., Тве, А. А., Ким, Ю. Дж., Ли, X., Ким, Х. Х., Парк, П. Б. и др. (2013). Характеристика генов предполагаемой гидроксициннамоил-кофермента А хинаттрансферазы и p -кумарат 3’-гидроксилазы и накопления хлорогеновой кислоты в винной гречке. J. Agric. Food Chem. 61, 4120–4126. DOI: 10.1021 / jf4000659
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Koes, R., Verweij, W., and Quattrocchio, F. (2005). Флавоноиды: красочная модель регуляции и эволюции биохимических путей. Trends Plant Sci. 10, 236–242. DOI: 10.1016 / j.tplants.2005.03.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кун, Б. М., Гейслер, М., Биглер, Л., и Рингли, К. (2011). Флавонолы накапливаются асимметрично и влияют на транспорт ауксина в Arabidopsis . Plant Physiol. 156, 585–595. DOI: 10.1104 / стр.111.175976
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, К., Чжао, П., Ли, Дж., Чжан, К., Ван, Л., и Рен, З. (2014). Полногеномный анализ семейства белков WD-повторов у огурца и Arabidopsis . Мол. Genet. Геномика 289, 103–124. DOI: 10.1007 / s00438-013-0789-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли Ю., Чен М., Ван С., Нин Дж., Дин X. и Чу З. (2015). AtMYB11 регулирует синтез кофеилхиновой кислоты и флавонолов в томатах и табаке. Культ растительных клеток и органов. 122, 309–319.DOI: 10.1007 / s11240-015-0767-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лихтенталер, Х. К. (1987). Хлорофиллы и каротиноиды: пигменты фотосинтетических биомембран. Methods Enzymol. 148, 350–382.
Google Scholar
Лю, Х., Го, З., Гу, Ф., Кэ, С., Сунь, Д., Донг, С., и др. (2016). Ген, подобный 4-кумарат-КоА-лигазе OsAAE3 , отрицательно опосредует устойчивость к взрывам риса, развитие цветков и биосинтез лигнина. Фронт. Plant Sci. 7: 2041. DOI: 10.3389 / fpls.2016.02041
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Махеш В., Миллион-Руссо Р., Ульманн П., Шабрийанж Н., Бустаманте Дж., Мондолот Л. и др. (2007). Функциональная характеристика двух генов 3’-гидроксилазы p -кумароилового эфира из кофейного дерева: свидетельство кандидата на биосинтез хлорогеновой кислоты. Завод Мол. Биол. 64, 145–159. DOI: 10.1007 / s11103-007-9141-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мартин, К., Бутелли, Э., Петрони, К., и Тонелли, К. (2011). Как исследования растений могут способствовать укреплению здоровья человека. Растительная клетка 23, 1685–1699. DOI: 10.1105 / tpc.111.083279
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Mehrtens, F., Kranz, H., Bednarek, P., and Weisshaar, B. (2005). Фактор транскрипции MYB12 Arabidopsis является флавонол-специфическим регулятором биосинтеза фенилпропаноидов. Plant Physiol. 138, 1083–1096.DOI: 10.1104 / стр.104.058032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Миллар Д. Дж., Лонг М., Донован Г., Фрейзер П. Д., Буде А. М., Данун С. и др. (2007). Введение смысловых конструкций циннамат-4-гидроксилазы (CYP73A24) в трансгенные растения томатов показывает противоположные эффекты на поток в стеблевой лигнин и фруктовые флавоноиды. Фитохимия 68, 1497–1509. DOI: 10.1016 / j.phytochem.2007.03.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Моко, С., Бино, Р. Дж., Ворст, О., Верховен, Х. А., де Гроот, Дж., Ван Бик, Т. А. и др. (2006). База данных метаболомов томатов на основе жидкостной хроматографии и масс-спектрометрии. Plant Physiol. 141, 1205–1218. DOI: 10.1104 / стр. 106.078428
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Морита, Ю., Сайто, М., Хосино, А., Нитасака, Э., и Иида, С. (2006). Выделение кДНК для регуляторов транскрипции R2R3-MYB, bHLH и WDR и идентификация мутаций c и ca , дающих белые цветы в японской ипомеи. Physiol растительных клеток. 47, 457–470. DOI: 10.1093 / pcp / pcj012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Оно, Э., Фукути-Мизутани, М., Накамура, Н., Фукуи, Ю., Йонекура-Сакакибара, К., Ямагути, М., и др. (2006). Желтые цветы, образованные экспрессией пути биосинтеза аурона. Proc. Natl. Акад. Sci. США 103, 11075–11080. DOI: 10.1073 / pnas.0604246103
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Оуэнс, Д.К., Алердинг, А. Б., Кросби, К. К., Бандара, А. Б., Вествуд, Дж. Х. и Винкель, Б. С. (2008a). Функциональный анализ предсказанного семейства генов флавонолсинтазы в Arabidopsis . Plant Physiol. 147, 1046–1061. DOI: 10.1104 / стр.108.117457
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Оуэнс, Д. К., Кросби, К. К., Рунак, Дж., Ховард, Б. А., и Винкель, Б. С. (2008b). Биохимическая и генетическая характеристика флаванон-3β-гидроксилазы Arabidopsis . Plant Physiol. Biochem. 46, 833–843. DOI: 10.1016 / j.plaphy.2008.06.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Петрусса, Э., Брейдот, Э., Занчани, М., Перессон, К., Бертолини, А., Патуи, С. и др. (2013). Растительные флавоноиды — биосинтез, транспорт и участие в стрессовых реакциях. Внутр. J. Mol. Sci. 14, 14950–14973. DOI: 10.3390 / ijms140714950
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пурсель, Л., Routaboul, J. M., Kerhoas, L., Caboche, M., Lepiniec, L., and Debeaujon, I. (2005). ПРОЗРАЧНЫЙ TESTA10 кодирует лакказеподобный фермент, участвующий в окислительной полимеризации флавоноидов в оболочке семян Arabidopsis . Растительная клетка 17, 2966–2980. DOI: 10.1105 / tpc.105.035154
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кирога, М., Герреро, К., Ботелла, М. А., Барсело, А., Амайя, И., Медина, М. И., и др. (2000). Пероксидаза томатов, участвующая в t
История томатов, происхождение томатов
История томатов интересна.Историки считают, что происхождение помидоров можно проследить до прибрежные высокогорья Центральной и Южной Америки, где они растут в диком виде в странах Эквадора и Перу. Их выращивали в древней Мексике.
Название «помидор» происходит от слова «томатль» на науане, языке ацтеков Центральной Америки. (Ацтеканец). Интересно, что слово «шоколад» также имеет науанское происхождение.
Представлен в Европе
испанским исследователям приписывают завезение помидоров в Европу в 1500-х годах, где они были называется помодоро, с испанского «золотое яблоко».Это говорит о том, что первые помидоры, завезенные в Европу были желтыми. Самое раннее зарегистрированное упоминание европейцем было венецианцем Пьетро Андреа Маттиоли, врач и натуралист, который в 1544 году рекомендовал приправлять солью, перцем и маслом. В добавление помидоров в итальянскую кухню в 18 веке дало нам нынешнюю форму пиццы.
Однако в северной части Европы история томатов повествует о растении, которое выращивали в теплицы как орнамент, который в лучшем случае был вреден для здоровья и, возможно, ядовит.Английский В 1864 году газета опубликовала статью, в которой утверждалось, что исследования показали, что помидор был не только съедобным, но и польза для здоровья. Спустя некоторое время некоторые производители уже выращивали томаты для потребления и экспорт. К 1880-м годам теплицы, построенные специально для выращивания томатов, уже были усеяны сельская местность вокруг Гернси, которая раньше была известна экспортом томатов.
Помидорный трюк полковника Джонсона
История Помидора включает эпизод, инсценированный в радиопередаче CBS 1940-х годов.Полковник Роберт Гиббон Джонсон из округа Салем, штат Нью-Джерси, впервые завез помидор в Соединенные Штаты из-за границы. в 1808 году. Предложив ежегодный приз за самый большой помидор, он пообещал публичную демонстрацию чтобы доказать, что помидор безопасен для употребления в пищу, а не просто декоративен. В 1820 году на ступенях Салема возле здания суда собралась толпа ликующих зрителей, чтобы посмотреть, как бедняга умирает от употребления ядовитый фрукт. Полковник Джонсон храбро сказал толпе, что съест целую корзину и выживет.К возможному огорчению нетерпеливой толпы полковник съел целую корзину помидоров без опрокидывается или страдает какими-либо болезненными последствиями. Правдива эта сказка или нет, мы знаем, что помидор стал одним из основных продуктов американской кухни.
Сад Томаса Джефферсона в Монтичелло
Третий президент США Томас Джефферсон зарегистрировал посадку томатов во всех лет он тщательно написал в своем «Садовом календаре» (1809-1824).Помидоры обычно появляются в Коллекции рецептов семьи Джефферсон. Двумя из его любимых разновидностей были «карликовый» и «испанский». Сегодня, если вы посетите его усадьбу в Монтичелло, штат Вирджиния, вам предложат туры по огородам, ежегодно проводится конкурс-дегустация помидоров. Среди недавних лучших финишеров — Sun Gold, Black. Вишня и Роза.
Популярность помидоров сегодня
Помидор — самый популярный сегодня садовый овощ.Это может быть потому, что их легко выращивать в семейном саду, и всего несколько растений дают хороший урожай. Аромат доморощенного помидор превосходит любой, который вы можете купить на местном рынке или в продуктовом магазине.
StartUp: Season 1 — Тухлые помидоры
Фильмы / TV
Знаменитости
Результатов не найдено
Посмотреть все- Дом
- Касса
- ТВ
- DVD
- БОЛЬШЕ
- Новости
- Моя учетная запись
- ПОДПИСАТЬСЯ АВТОРИЗОВАТЬСЯ
- Фильмы и DVD
Фильмы в кинотеатрах
- Открытие на этой неделе
- Верхняя касса
- Скоро в театрах
- Выходные доходы
- Сертифицированные свежие фильмы
На DVD и потоковом воспроизведении
- FandangoNOW
- Netflix Streaming
- iTunes
- Amazon и Amazon Prime
- Лучшие DVD и потоковое воспроизведение
- Новые релизы
- Скоро на DVD
- Сертифицированные свежие фильмы
- Просмотреть все
Более 350 сортов семян томатов — Семена помидоров семейной реликвии
Уважаемые покупатели.
Сообщаем Вам, что после оформления заказов, каталог будет обновлен 30 января 2021 года.
Некоторые разновидности будут восстановлены для продажи.
Благодарим за понимание и приглашаем в магазин с 30 января.
В настоящее время заказы отправляются через 7 дней после оплаты.
Ежегодная распродажа семян томатов семейной реликвии!
Скидки до 50% на избранные сорта.
Отличные помидоры за 1 евро.
БЕСПЛАТНАЯ ДОСТАВКА ДЛЯ ЗАКАЗОВ ОТ 20 ЕВРО.
3 пакета семян бесплатно при заказе на сумму свыше 30 евро.
Tomato Eden — один из крупнейших и наиболее разнообразных складских запасов семян томатов в Европе. Наша компания предлагает семена семейных реликвий и редкие семена томатов, которые давно забыты в нашем современном мире и которые невозможно найти в коммерческих магазинах или каталогах садоводов.
Наша семья выращивает овощи более 40 лет.Это наша работа и наша страсть. Мы любим делиться своими знаниями и опытом с нашими уважаемыми клиентами и всегда рады ответить на вопросы, касающиеся выращивания томатов. Мы специализируемся на выращивании редких и уникальных сортов, хорошо подходящих для более прохладного климата, а также традиционных и крупноплодных помидоров. Наш выбор с каждым годом расширяется, поскольку мы выбираем новые сорта растений для выращивания.
Несмотря на суровый климат Восточной Европы, мы выращиваем и собираем все растения на нашей семейной ферме в гармонии с природой.Предлагаемые нами семена не являются генетически модифицированными и не выведены гетерозисом. Все фотографии на этом сайте сделаны нами и изображают растения в их естественном виде. Мы гордимся тем, что можем предложить вам семена высочайшего качества, а также первоклассное обслуживание клиентов. Мы делаем все возможное, чтобы удовлетворить наших клиентов, обрабатывая каждый заказ с особой тщательностью и вниманием. Наша компания представлена сайтом Allegro.pl, который является польским эквивалентом Ebay. Нам доверяют тысячи клиентов, о чем свидетельствуют 8300 положительных отзывов, которые мы получили за короткий период в три года.
Мы рады поделиться с вами нашей страстью к садоводству! Приятных покупок! Пожалуйста, поставьте нам лайк на Facebook.
Томатосфера — Томатосфера | Жизненный цикл растения томата
Жизненный цикл растения томатаРепродукция
Томатные растения принадлежат к группе растений, известных как цветковые или покрытосеменных . Помидор размножается половым путем, а это означает, что для производства семян ему необходимы как женские, так и мужские органы. Внутри каждого семечка томата есть крошечный куст.При подходящих условиях семена томатов прорастут и . По мере прорастания семян сначала появляется корень , или молодой корень, который прорастает в землю. Затем появляются семядоли , или семенные листья, которые растут по направлению к Солнцу, и у молодого растения появляются настоящие листья. По мере взросления растения появляется больше листьев и образуются цветочные почки (см. Рисунок 1). На зрелых растениях томатов развиваются цветы, и именно здесь происходит половое размножение .
Рис. 1: Схема жизненного цикла томата.Жизненный цикл начинается с семян, а по мере роста и созревания растения развиваются цветы. После опыления и оплодотворения развиваются плоды, содержащие семена, что позволяет возобновить жизненный цикл.
Источник: адаптировано из Thunderbolt Kids
Подробнее о прорастании семян томатов читайте на справочной странице:
Прорастание семянЦветочная структура
Цветы важны для размножения и производства семян. Цветок томата иногда называют идеальным цветком, потому что мужские и женские органы расположены внутри одного цветка (см. Рисунок 2).
Рисунок 2: Схема цветка томата и его плода. Завязь внутри цветка превращается в плод помидора, который мы едим. Лепестки, тычинки и рыльца засыхают и опадают по мере созревания плода.
Источник: адаптировано из частей для эльфов
Цветок томата состоит из четырех основных частей:
- Чашелистник: Эта часть цветка зеленого цвета впервые видна при формировании бутона. Он защищает бутон еще до того, как он распустится.
- Лепесток: Это часть цветка, которая привлекает шмелей. У цветов томатов лепестки обычно желтого цвета.
- Тычинки: Это мужская часть цветка. Обычно он состоит из нити и пыльника с пыльцой , которая находится в верхней части нити. Пыльца содержит мужскую генетическую информацию. У цветков томатов тычинки срослись в трубчатую структуру.Они тоже желтые, как лепестки.
- Пестик: Это женская часть цветка. Он состоит из клейма , стиля и завязи и расположен в центре цветка, окруженный тычинками.
Женский репродуктивный орган, яичник, расположен у основания пестика. Яичник содержит семяпочки. После того, как семяпочки оплодотворены, эмбрион может развиться и образовать семена, которые будут найдены внутри плодов томата.
Развитие плода
Чтобы цветы превратились в плод помидора, который мы едим, в цветках должны произойти две вещи: опыление и оплодотворение .
- Опыление: Это процесс, при котором пыльца с пыльников откладывается на рыльце. Это может быть сделано ветром ( опыление ветром ) или шмелями через опыление жужжанием .
Опыление с помощью жужжания происходит, когда пчела приземляется на цветок и начинает вибрировать своими мускулами полета.Это движение может стряхнуть с цветка рыхлую пыльцу. Некоторые из этих пыльцевых зерен могут попасть в другие цветы, что приведет к их опылению. - Оплодотворение: во время этого процесса мужская и женская гаметы , полученные из пыльцы и семяпочки, объединяются. Это похоже на соединение сперматозоидов и яйцеклеток у животных. Две гаметы соединяются в завязи и развиваются в семя, которое содержит зародыш , эндосперм и оболочку семян . Как только семена сформируются, жизненный цикл томата может начаться заново.
Фрукты или овощи?
Помидор — это фрукт или овощ? С кулинарной точки зрения помидор считается овощем в первую очередь потому, что он несладкий и обычно не используется в десертах. С ботанической точки зрения помидор — это фрукт. Плод определяется как часть растения, которая развивается из завязи цветка и содержит семена. Поскольку помидор развивается из завязи своего цветка и содержит семена, то на самом деле помидор является фруктом, а не овощем.
Глоссарий
Покрытосеменные
Цветущее растение.
Пыльник
Часть тычинки, на которой образуется пыльца.
Опыление жужжанием
Этот процесс происходит, когда шмели приземляются на цветы и стряхивают пыльцу с тычинок, сокращая свои летательные мышцы, вызывая вибрацию.
Семядоли
Часть зародышевого растения, которая станет первыми листьями. Они также известны как семенные листья.
Эмбрион
Крошечное незрелое растение внутри семени.
Эндосперм
Часть семени, хранящая пищу для использования эмбрионом во время прорастания.
Удобрение
Процесс, при котором две гаметы соединяются и развиваются в семя.
Гаметы
Клетки, которые могут сливаться во время полового размножения и каждая из которых содержит половину генетической информации. У цветковых растений мужская гамета находится в пыльце, а женская гамета — в семяпочке.
Прорастание
Процесс роста растения из семени.Обычно это происходит после периода покоя. Хорошие условия окружающей среды важны для начала прорастания.
Нить
Часть тычинки, которая поддерживает пыльник.
Яичник
Часть пестика, содержащая семяпочки.
Яйцо
Находится в яичнике женщины. Он содержит женскую генетическую информацию и после оплодотворения может развиться в семя.
Педицель
Стебель, прикрепляющий цветок к основному растению.
Лепесток
Это часть цветка, которая привлекает шмелей. У цветов томатов лепестки обычно желтого цвета.
Пестик
Женская часть цветка. Он состоит из стигмы, стиля и содержит яичник и семяпочки, которые содержат женскую генетическую информацию.
Пыльца
Находится на пыльнике в верхней части нити, которая содержит мужскую генетическую информацию.
Радикл
Часть эмбриона, которая станет корнем.
Семенной покров
Защитное покрытие семени.
Рассада
Молодое растение, развивающееся из семян.
сепал
Эта часть цветка зеленого цвета впервые видна при формировании бутона. Он защищает бутон еще до того, как он распустится.
Половое размножение
У растений этот тип размножения происходит, когда мужская пыльца откладывается на женских органах растения, чтобы произвести семена.
Тычинки
Это мужская часть цветка.Он состоит из нити и пыльника с пыльцой, в которой содержится мужская генетическая информация.
Стигма
Это часть пестика. Он расположен на вершине стиля, над завязью. Здесь пыльца откладывается для удобрения.
Стиль
Часть пестика выше завязи и ниже рыльца.
Опыление ветром
Это процесс, который происходит, когда цветы опыляются ветром.

