Нашатырный спирт в быту: 9 способов применения
Первое, с чем ассоциируется нашатырь, это его способность выводить человека из предобморочного состояния, а некоторые из нас встречались с этим пузырьком в процедурных во время сдачи крови. Но не многие знают, что в быту нашатырный спирт полезен не меньше, чем в медицине. Способов применения 10%-го раствора аммиака в хозяйственных целях немало, и мы подобрали самые эффективные из них.
Выведение пятен
Для удаления загрязнений раствор аммиака в бытовых целях применяют, пожалуй, чаще всего. И, конечно же, в основном там, где привычные моющие средства применять либо неудобно, либо неэффективно.
- Нашатырь можно использовать для чистки ковров или мебельной обивки, и работать он будет получше покупной бытовой химии, к тому же, вымывать пену из ткани вам не придется.
- Также таким раствором можно очищать замшевую обувь, сумки и перчатки, ведь стирать из нельзя, а обработка обычным пятновыводителем будет требовать контакта с водой.
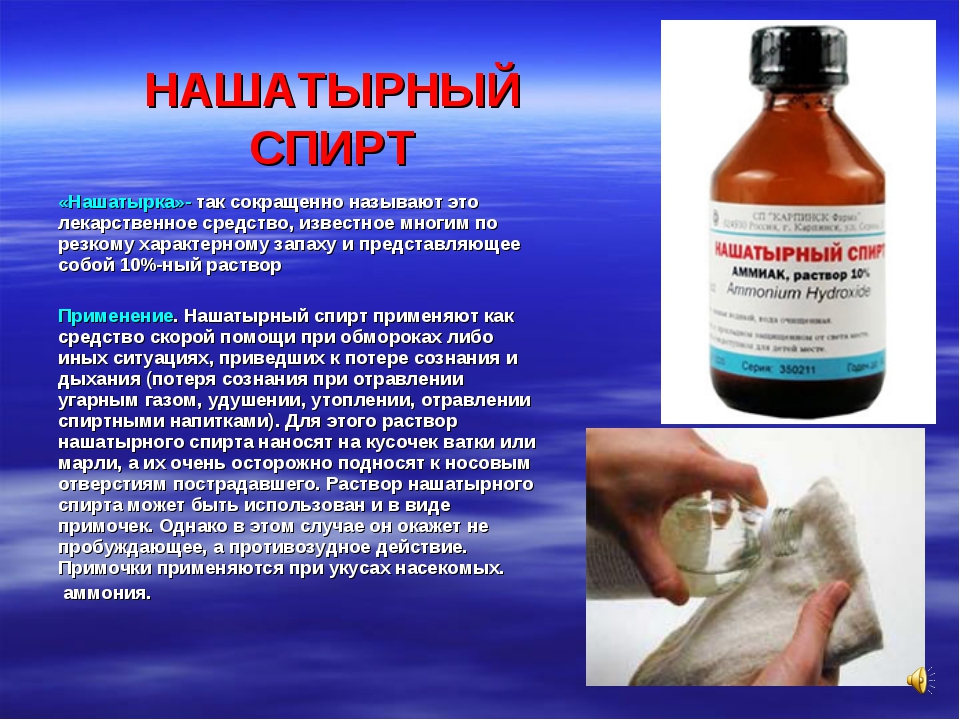 В этом случае раствор нашатыря наносится на замшу ватным диском: грязь будет впитываться спиртом, а диски нужно будет менять, пока они не станут чистыми.
В этом случае раствор нашатыря наносится на замшу ватным диском: грязь будет впитываться спиртом, а диски нужно будет менять, пока они не станут чистыми. - А еще нашатырь незаменим для выведения жирных пятен с любых тканей, в том числе и обычной одежды. Обработайте пятно раствором, а потом запустите обычную стирку в машинке: от засаленных пятен на манжетах и воротниках не останется следа.
Какой концентрации приготовить раствор для этих манипуляций? Чем больше нашатыря вы добавите на 100 мл воды, тем сильнее и быстрее будут проявляться его свойства, но и агрессивное воздействие на структуру ткани будет расти. Наиболее распространенный раствор для чистки, который советуем применять и мы, – 1 часть нашатырного спирта и 5 частей воды, хотя при необходимости можно увеличить или уменьшить насыщенность смеси.
Отбеливание
Помимо выведения пятен нашатырный спирт в быту используется для возвращения вещам первозданного кипенно-белого цвета, и с этой задачей он тоже справляется на ура. Правда, в одиночку он работает не так хорошо, как с помощником в виде перекиси водорода, так что запаситесь обоими средствами. Детские колготки, вашу рабочую блузку и даже тюль, пожелтевший от солнца, будем замачивать в одном и том же растворе: в 4-5 литров горячей воды (около 70 ˚С) добавьте 50 мл перекиси и 25 мл нашатыря, замочите в нем вещи на несколько часов, а затем тщательно прополощите. Стоит отметить, что эта процедура не заменяет стирку и должна проводиться на вещах, уже очищенных от сильных загрязнений.
Правда, в одиночку он работает не так хорошо, как с помощником в виде перекиси водорода, так что запаситесь обоими средствами. Детские колготки, вашу рабочую блузку и даже тюль, пожелтевший от солнца, будем замачивать в одном и том же растворе: в 4-5 литров горячей воды (около 70 ˚С) добавьте 50 мл перекиси и 25 мл нашатыря, замочите в нем вещи на несколько часов, а затем тщательно прополощите. Стоит отметить, что эта процедура не заменяет стирку и должна проводиться на вещах, уже очищенных от сильных загрязнений.
Совет
Белые вещи, ставшие жертвой случайно попавшего яркого носка в стиральную машину, тоже можно спасти при помощи такого замачивания, если, конечно, цветная ткань полиняла не слишком сильно.
Чистка поверхностей
Раствор аммиака убирает сильные загрязнения с кафельной плитки, раковины или духовки ничуть не хуже, чем с тканей, так что тем же раствором можно вымыть всю квартиру.
- Нашатырь отлично подходит для чистки стекол, зеркал и других изделий из стекла, вроде люстр и даже бокалов.
 Хорош он тем, что даже в растворе не оставляет разводов и придает блеск.
Хорош он тем, что даже в растворе не оставляет разводов и придает блеск. - Раствором нашатыря, нанесенным на ватный диск, можно чистить даже подошву утюга, чтобы та не оставляла некрасивые разводы на одежде.
- Кафельную плитку раствор нашатыря ототрет от жирных пятен, если это кухонный фартук, следов от жесткой воды, если это ванная, и грязи, если это пол.
- Нашатырь хорошо справляется с жирными пятнами, поэтому его раствором можно мыть плиту и духовку, конечно же, не включая при этом газ: это все-таки спирт.
Дезинфекция
Для той же кафельной плитки обработка нашатырем – это не просто чистка, но и профилактика грибка и плесени, из-за которых затирка между плитками выглядит просто ужасно. Конечно, для дезинфекции рук лучше применять обычный спирт, а вот предметы обрабатывать с помощью нашатыря вполне можно. Например, в растворе аммиака замачивают расчески-щетки для волос, которые сложно качественно промыть и продезинфицировать другим путем.
Чистка металлов
Замачивание в растворе нашатыря изделий из серебра, золота и других металлов – еще один полезный совет, который подтвердят даже владельцы ювелирных мастерских. Одинаково хорошо он сработает и для старой бабушкиной золотой подвески, так и для окислившихся серебряных ложек.
Одинаково хорошо он сработает и для старой бабушкиной золотой подвески, так и для окислившихся серебряных ложек.
Репеллент
Применение нашатырного спирта в быту не ограничивается областью чистки: сослужить службу он может и в борьбе с насекомыми, решившими поселиться в вашей квартире. Бурые муравьи, которых зачастую просто нереально вывести традиционными способами, забудут дорогу на вашу кухню, если учуют запах нашатыря. Также его можно брать с собой на вылазки: работает он не хуже фабричных репеллентов, а стоит намного меньше.
Совет
Если нанести крохотное количество нашатырного спирта на укус насекомого, то он перестанет чесаться.
Средство для красоты
Интересными свойствами нашатырь обладает для сухой и проблемной кожи ступней. Если добавлять буквально по паре капель этого средства в ванночки, кожа смягчается, трещинки заживают быстрее, неприятный запах отступает, а загрубение кожи происходит медленнее.
Важно!
Нашатырный спирт применяется в небольших количествах внутрь для вызывания рвоты при отравлениях, но вне медицинских учреждений в таких целях его лучше не использовать: небольшая передозировка – и вы получите ожог слизистых и серьезное отравление.
Устранение запахов
Еще один полезный совет по применению нашатырного спирта в быту – устранение въевшихся неприятных запахов в помещении. Если расставить небольшие емкости с нашатырем по комнате, то через некоторое время запах уйдет, и, хотя от нашатыря квартиру придется проветривать долго и тщательно, скоро в ней не будет никаких запахов, кроме запаха чистоты.
Удобрение
Сложно поверить в то, что вещество с таким едким запахом, да еще и спирт, может быть полезно для растений, но с некоторыми видами это действительно так. Правда, его добавляют в небольшом количестве, чтобы не навредить рассаде. Садоводы утверждают, что так она вырастает сильнее и крепче.
Если мы упустили какой-то способ применения нашатыря в быту, то только потому, что их действительно много: спешите воспользоваться многофункциональностью этого средства во имя чистоты в вашем доме и не только.
Самый большой список применения нашатырного спирта
Применение нашатыря на даче
Обработка от вредителей
- Борьба с паутинным клещом
- Обработка капусты от вредителей
- Опрыскивание деревьев и кустарников от тли
- Нашатырь против морковной мушки
- Защита огорода от медведки
- Средство от проволочника
- Уничтожение скрытнохоботника
- Помощник от муравьев
- Отпугивание комаров и мух
- Обработка контейнеров для рассады
- Использования нашатыря при высадке рассады в открытый грунт
- Азотная подкормка овощных культур
- Удобрение редиса
- Полив лука нашатырным спиртом
- Спасение капусты нашатырем
- Польза для тыквы и кабачков
- Эффективный способ посева моркови
- Защита картофеля
- Профилактика пожелтения чеснока
- Обработка огурцов
- Помощь в выращивании помидор
- Благотворное влияние на баклажаны
- Увеличение урожая клубники
- Питание малины Применение нашатырного спирта на даче, в быту, в косметологии и медицине.
- Уход за хрустальной посудой
- Придание блеска люстре
- Мытье окон
- Чистка жалюзи
- Удаление плесени
- Мытье стен, покрашенных масляной краской
- Удаление пятен с кафеля
- Придание блеска серебряным столовым приборам
- Чистка никелированных поверхностей
- Мытье духовки
- Освежает холодильник
- Удаление темного налета с серебряных изделий
- Отмывает подошву утюга
- Чистка автомобильных фар
- Подкормка домашних растений
- Спасение комнатных растений от щитовки
- Стирка и отбеливание
- Удаление пятен с мягкой мебели
- Обновление лайковых перчаток
- Удаление пятен от духов с одежды
- Чистка зонтов
- Уход за замшевыми вещами
- Выведение пятен йода
- Уход за меховыми изделиями
- Маска для красивых пяточек
- Чистые ручки после огорода
- Уменьшение зуда от укуса насекомых
- Чистка массажных расчесок
- Быстрая помощь при обмороках
Рассада
Подкормка овощей и ягод

В быту
Уборка
Уход за домашними растениями
Стирка и удаление пятен
Красота и уход за собой
Медицина
Применение нашатырного спирта в быту на даче и медицине
Нашатырный спирт – это прозрачная летучая жидкость с химическим ядовитым запахом.
Аммиак – это азотоводородистое соединение. В хим. промышленности его используют для самых разных целей.
Природный аммиак выходит при разложении азотосодержащих органических останков.
Азот с водородом образуют бесцветный газ с резким удушающим запахом и очень горьким вкусом.
Аммиак относится к очень ядовитым продуктам. Он сильно раздражает слизистые оболочки. Острое отравление аммиаком вызывает поражение слизистых оболочек глаз и легких, одышку, воспаление кожных покровов.
Если здоровый человек вдохнет пары аммиака, его печень превратит аммиак в мочевину, которая выйдет из организма с водой.
Однако люди с нарушенной функцией печени не смогут быстро избавиться от этого вещества. Результатом будет чрезмерная концентрация аммиака в крови. Это может вызвать приступы и кому, исход бывает фатальным.
Аммиак следует хранить в стальных баллонах, их окрашивают в желтый цвет, с черной надписью – аммиак. Сам аммиак применяют ограниченно и обычно в виде водных растворов (аммиачная вода – как жидкое удобрение, нашатырный спирт – в медицине).
Сам аммиак применяют ограниченно и обычно в виде водных растворов (аммиачная вода – как жидкое удобрение, нашатырный спирт – в медицине).
Нашатырный спирт смешивается с водой и спиртом во всех пропорциях. Он обычно содержит 10% аммиака и 90% воды.
В таком виде его используют для решения бытовых проблем. Для промышленности данный спирт изготавливают в два этапа: сначала вырабатывают гидрат аммония из аммиака. Полученный гидрат смешивают с водой. В итоге получается нашатырный спирт (ещё его называют гидроксид аммония).
Для любителей «горячительного» эта жидкость точно не подойдет, так как спирта в ней нет. Дело в том, что в средние века спиртом называли все летучие вещества (от лат. spiritus — дух). Если говорить по существу – это просто очень необычная щелочь.
Применение нашатырного спирта
Человек знал об этом веществе с древних времен, о нем писал римский автор Плиний. В средние века начали получать жидкую форму из ферментированной мочи, её использовали для окраски одежды.
Гидроксид аммония — это универсальный продукт, который помогает решать многие задачи в доме. Вместо того, чтобы переполнять свои полки специализированными очистителями, можно использовать одну бутылку этого средства для решения многих бытовых проблем.
- Он используется для очистки полов, стен, душевых кабин, прилавков, плиток и бытовой техники. Протертые им вещи и приборы начинают блестеть с невероятной силой. Мучнистую росу, царапины, потускневшие приборы и пятна на одежде, а также ковровые пятна можно удалить этим спиртом.
- Это едкое вещество отлично поможет избавить жилище от комаров и муравьев. Они терпеть не могут запах нашатыря. Также можно расставить в квартире емкости с этим средством, чтобы избавиться от неприятного запаха сигарет, краски и др.
- В медицинских целях его применяют, например, при обмороках.
 Так как он обладает очень резким запахом, при поднесении ватки с этим веществом к носу человека раздражаются рецепторы, человек приходит в сознание.
Так как он обладает очень резким запахом, при поднесении ватки с этим веществом к носу человека раздражаются рецепторы, человек приходит в сознание. - Кроме того разбавленный аммиак прекрасно подходит для обеззараживания рук. Им часто пользуются хирурги перед операцией.
Меры безопасности
В связи с тем, что водный раствор аммиака принадлежит к 4 классу опасности (малоопасные вещества), взаимодействовать с ним необходимо крайне осторожно. Необходимо соблюдать все меры безопасности: нужно использовать медицинские перчатки, респиратором желательно защитить лицо, хранить это средство необходимо вдали от детей, емкость должна быть плотно закрытой.
Нельзя позволять этому средству соприкасаться с глазами или иметь длительный контакт с кожей. Необходимо избегать вдыхания паров аммиака и всегда надо использовать данный продукт в хорошо проветриваемом помещении.
Он может повредить резину и некоторые пластмассы. Никогда нельзя смешивать нашатырный спирт и отбеливатель — это высвобождает токсичный газообразный хлор. По этой причине надо быть осторожным, чтобы не допустить смешивания данного продукта с очистителями для туалета и плитки на основе отбеливателя.
Никогда нельзя смешивать нашатырный спирт и отбеливатель — это высвобождает токсичный газообразный хлор. По этой причине надо быть осторожным, чтобы не допустить смешивания данного продукта с очистителями для туалета и плитки на основе отбеливателя.
Теги: нашатырный спирт
Читайте так же статьи:
инструкция по применению, показания, побочные действия
Описание
Прозрачная бесцветная летучая жидкость с характерным острым запахом аммиака.
Состав
Одна ампула (1 мл) содержит: действующего вещества – аммиака раствора концентрированного – 0,44 мл, вспомогательное вещество – вода очищенная.
Фармакотерапевтическая группа
Стимуляторы дыхания.
Код АТХ: R07AB.
Фармакологические свойства
Фармакодинамика
Аналептическое средство; оказывает стимулирующее действие на дыхательный центр – рефлекторно, действуя через рецепторы верхних дыхательных путей (окончания тройничного нерва). Вдыхание паров аммиака в высоких концентрациях вызывает рефлекторную остановку дыхания. При местном на-несении на кожу — антисептическое действие. При длительном контакте раздражающее действие на кожу и слизистые оболочки может переходить в при-жигающее (коагуляция белков) с развитием гиперемии, отечности и болезненности.
При местном на-несении на кожу — антисептическое действие. При длительном контакте раздражающее действие на кожу и слизистые оболочки может переходить в при-жигающее (коагуляция белков) с развитием гиперемии, отечности и болезненности.
Быстро выводится с выдыхаемым воздухом.
Фармакокинетика
Аммиак не попадает в системный кровоток, быстро выводится с выдыхаемым воздухом.
Показания к применению
Аммиак используют в качестве средства скорой помощи для стимуляции дыхания и выведения больных из обморочного состояния.
Местно: в виде примочек при укусах насекомых.
Противопоказания
Повышенная чувствительность к активному веществу. Для наружного применения — кожные заболевания (в т.ч. дерматит, экзема), детский возраст до 3 лет.
Для наружного применения — кожные заболевания (в т.ч. дерматит, экзема), детский возраст до 3 лет.
Способ применения и дозы
Ингаляционно, местно. Для стимуляции дыхания и выведения больных из обморочного состояния – ингаляционно: осторожно подносят небольшой кусок ваты или марли, смоченной аммиаком, к носовым отверстиям (на расстояние 0,5 – 1 см).
При укусах насекомых применяют местно в виде примочек (длительность процедуры – до 30 секунд).
Побочное действие
При вдыхании паров раствора аммиака может возникнуть рефлекторная остановка дыхания, гиперсаливация, першение в горле, гиперемия слизистой оболочки полости рта. При местном применении возможны раздражения, дерматиты, экземы в месте аппликации, аллергические реакции. При случайном проглатывании – ожог пищевода и желудка.
При местном применении возможны раздражения, дерматиты, экземы в месте аппликации, аллергические реакции. При случайном проглатывании – ожог пищевода и желудка.
Передозировка
Усиление проявлений побочных реакций. Лечение симптоматическое.
Меры предосторожности
При местном применении нанесение раствора аммиака возможно только на неповреждённую кожу.
Избегать попадания в глаза. При случайном поражении слизистой оболочки глаз – промывать глаза водой несколько раз (в течение 15 мин с перерывом 10 мин) или 3 % раствором борной кислоты. Масла и мази не применяют. При поражении носа и глотки применяют 0,5 % раствор лимонной кислоты или натуральные соки. В случае приёма внутрь – пить воду, фруктовый сок, молоко, 0,5 % раствор лимонной кислоты или 1 % раствор уксусной кислоты до полной нейтрализации содержимого желудка. Особенно чувствительны к действию аммиака дети, поэтому следует соблюдать осторожность при использовании средства в данной возрастной категории, не применять у детей до 3 лет.
Применение во время беременности или кормления грудью
В период беременности и кормления грудью применение лекарственного средства возможно лишь в том случае, когда ожидаемая польза для матери пре-вышает потенциальный риск для плода и ребенка.
Влияние на способность управлять транспортными средствами и другие виды деятельности, связанные с необходимостью концентрации внимания
Не влияет.
Не следует нарушать правила применения лекарственного средства, это может нанести вред Вашему здоровью.
Не использовать у детей до 3-х лет, у детей старше 3-х использовать с осторожностью.
Взаимодействия с другими лекарственными средствами
Не установлены.
Упаковка
По 1 мл в ампулах из стекла. 10 ампул вместе с ножом для вскрытия ампул и листком-вкладышем помещают в коробку из картона.
Условия хранения
При температуре не выше 25 °С. Хранить в недоступном для детей месте.
Срок годности
5 лет. Лекарственное средство не использовать после окончания срока годности.
Лекарственное средство не использовать после окончания срока годности.
Условия отпуска из аптек
Без рецепта.Информация о производителе
Открытое акционерное общество «Борисовский завод медицинских препаратов», Республика Беларусь, Минская обл., г. Борисов, ул. Чапаева, 64, тел/факс +375(177)735612, 731156.
полезные свойства и применение в народной медицине
Довольно широкое применение в современной традиционной и нетрадиционной медицине имеет нашатырный спирт – 10% водный бесцветный раствор гидроксида аммония. Средство впервые было открыто египетскими жрецами, которые извлекали из навоза верблюдов прозрачные кристаллики — «нушадир». Впоследствии этим кристаллам дали название «нашатырь».
Впоследствии этим кристаллам дали название «нашатырь».
Название «аммиак» появилось от оазиса Амон в Аравийской пустыне. Именно там, в древние века ночевали караваны. Верблюжий навоз накапливался в пустынях на протяжении многих лет и от него исходил довольно острый и резкий аммиачный запах. Этот запах способен вызывать возбуждение дыхательных центров, но в избытке он провоцирует остановку дыхания.
Содержание статьи:
Полезные свойства нашатырного спирта
В былые времена женщины носили с собой маленькие флаконы с «нюхательной солью», так как боялись упасть в обморок из-за невыносимой духоты. Ничего не изменилось и в наше время, нашатырь является лучшим помощником при обмороках. Достаточно смочить ватку раствором и поднести к носу человека, который потерял сознания, и он сразу приходит в чувство.Что касается физиологического действия нашатырного спирта, то оно обусловливается острым, довольно неприятным запахом, который способствует раздражению специфических рецепторов слизистой носа и возбуждению дыхательных и сосудодвигательных мозговых центров, повышая артериальное давление и учащая дыхание и сердцебиение.
А еще его применяют в случае укусов насекомых. Оно также оказывает противомикробное воздействие.
Его используют для очистки кожи. Людям, которые страдают от бронхитов, рекомендуется прием нашатырно-анисовых капель (в качестве отхаркивающего средства).
При насморке и чихании
Нашатырный спирт является незаменимым помощником в случае возникновения продолжительных и частых «чихов». Организм каждого человека индивидуален и, соответственно, реакции на проявление простудных признаков также индивидуальны. Одни чихнут пару разу и все, а другие могут чихать до изнурения на протяжении десяти и более минут. И в таком случае спасением являются «понюшки» нашатыря.
Для приготовления средства вам понадобится небольшая бутылочка. Практически до самого верха необходимо залить нашатырный спирт. В свободное пространство добавить растительное масло. Так как оно легче, чем спирт, то расположится вверху бутылочки.Основным назначением масла является исключение быстрого испарения спирта. Когда появляется насморк или чихание, необходимо тщательно взболтать флакончик и поочередно поднести сначала к одному, а затем к другому носовому ходу. Когда будете вдыхать пары, не забывайте закрывать вторую ноздрю.
Когда появляется насморк или чихание, необходимо тщательно взболтать флакончик и поочередно поднести сначала к одному, а затем к другому носовому ходу. Когда будете вдыхать пары, не забывайте закрывать вторую ноздрю.
Интенсивность и глубина таких «вдыханий» должна увеличиваться постепенно, иначе от переизбытка вдыхаемых паров может возникнуть весьма неприятное чувство, которое в народе называется «прошибание мозгов».
Чтобы освободить носовые ходы от слизистых выделений, повторяйте процедуру, пока признаки насморка не исчезнут.
Рецепт приготовления и применения микстуры
Возьмите одну ложку соли, залейте ее литром воды и хорошенько размешайте. В отдельную посудину влейте 100 мл 10%-ого нашатыря и 10 мл камфорного спирта. Хорошенько размешайте содержимое и соедините две смеси. Должны появиться хлопья белого цвета. Вам необходимо закрыть емкость крышкой и взбалтывать до того момента, пока не растворятся хлопья. Готовый препарат можно хранить не более одного года.
- Микстуру применяют и для устранения головных болей. Для этого нужно подогреть ее в теплой воде, смазать больное место и завязать на ночь теплой тканью.
- Точно также делайте в случае появления болей в суставах.
- Эта же микстура рекомендуется при ушных болях при отите. Необходимо промокать в средстве кусочек ватки, слегка отжать и положить в ушную раковину. Дополнительно смажьте область вокруг уха.
- Если болит зуб, нужно приложить к нему ватку, смоченную в препарате. Болезненные ощущения уйдут через двадцать минут.
Боли в суставах
1. Возьмите одну ложку нашатыря и три ложки воды. Замесите тесто, сделайте лепешку и прикладывайте к пораженным участкам. Обмотайте теплым платком.2. Возьмите настойку красного перца и гидроксид амония в соотношении 1:5. Растирайте полученным лекарством болезненное место при остеохондрозе.
3. Для приготовления препарата от полиартрита вам понадобится мед, йод, нашатырный спирт, медицинская желчь и глицерин. Все составляющие необходимо взять в равной пропорции – по одному стакану. Хорошенько перемешайте все ингредиенты. Перед применением в обязательном порядке взбалтывайте. Прикладывайте к пораженным участкам на 24 часа.
Все составляющие необходимо взять в равной пропорции – по одному стакану. Хорошенько перемешайте все ингредиенты. Перед применением в обязательном порядке взбалтывайте. Прикладывайте к пораженным участкам на 24 часа.
Бронхиальная астма и хронический бронхит
Возьмите теплое молоко – 100 мл и несколько капель нашатыря. Соедините жидкости вместе и хорошо взболтайте. Спирт должен осесть на дно. Выпивайте готовое средство за 10-15 минут перед приемом пищи. Главное правило – все блюда и вода должны быть теплыми. Продолжительность курса – один месяц.
Возьмите полстакана горячего козьего молока и капните в него пару капель спирта. Тщательно перемешайте и принимайте каждые два часа пока не пройдет кашель.
Рецепты с нашатырем для лечения различных заболеваний
1) Радикулит.
Для приготовления рецепта вам нужно взять плоды туи – пару горсток, и залить их половиной литра нашатыря. Оставьте настаиваться, желательно в теплом сухом месте, на четыре недели. По истечении времени, процедите и добавьте четыре пузырька йода. Этим средством смазывайте больное место перед отходом ко сну. В обязательном порядке укутайте поясницу.
По истечении времени, процедите и добавьте четыре пузырька йода. Этим средством смазывайте больное место перед отходом ко сну. В обязательном порядке укутайте поясницу.
2) Выведение из запоя, снятие опьянения.
Десять капелек спирта необходимо накапать в стакан воды. Употреблять по стакану трижды в день.
3) Пролежни.
Возьмите глицерин – 100 г и нашатырный спирт — 50 мл. Тщательно перемешайте. Полученным раствором необходимо смазывать пролежни. После того, как он впитается, присыпьте детской присыпкой.
4) Эндемический зоб.
Возьмите семена дурмана – две столовые ложки и пол литра гидроксида амония. Высыпьте семена в бутылку, наполненную спиртом, и оставьте настаиваться на три недели. Необходимо периодически взбалтывать настойку. Как только средство настоится, смазывайте им шею, а затем укутывайте теплым платком. Продолжительность лечения – десять дней. Сделайте перерыв в пять дней, и повторите курс. Применяют до полного выздоровления.
5) Пяточная шпора.
Возьмите 1 мл салициловой кислоты, 2 мл уксусной кислоты, 1 мл нашатырного спирта, 5 г серы, 30 мл камфорного спирта, 50 мл 96%-ого спирта. Перемешайте тщательно все ингредиенты. В полученном составе смочите ватку, наложите на шпору и укрепите при помощи лейкопластыря.
6) Ячмень.
Как только увидели небольшой гнойничок, необходимо сразу обмакнуть спичку в спирт и немного оттянув веко прикоснуться к пораженной области. Поверьте, ячмень пропадет, не успев полностью созреть.
Противопоказания
Ни в коем случае не давайте нюхать спирт больным эпилепсией. В противном случае вы рискуете возобновлением припадков. Нельзя применять препараты на основе нашатыря людям с наличием экземы, дерматитов и других острых болезней кожи.
Теперь вы понимаете, что нашатырный спирт — незаменимое народное средство, которое должно быть в каждой домашней аптечке. А у вас оно есть?
Нашатырный спирт – как применять для подкормки растений и борьбы с вредителями
Всем известен нашатырный спирт — прозрачная светлая жидкость с резким запахом. Сейчас едва ли найдется семья, где в аптечке у них не было бы этого препарата. Это самое первое средство, когда нужно человека вывести из обморочного состояния или вызвать рвоту при отравлении алкоголем. В составе мази он применяется при укусах насекомых, миозите и невралгии. И в быту ему нашлось применение для мытья окон, зеркал, хрусталя, выведения пятен на одежде. А садоводы и огородники нашли ему применение для подкормки растений и борьбы с вредителями.
Сейчас едва ли найдется семья, где в аптечке у них не было бы этого препарата. Это самое первое средство, когда нужно человека вывести из обморочного состояния или вызвать рвоту при отравлении алкоголем. В составе мази он применяется при укусах насекомых, миозите и невралгии. И в быту ему нашлось применение для мытья окон, зеркал, хрусталя, выведения пятен на одежде. А садоводы и огородники нашли ему применение для подкормки растений и борьбы с вредителями.
Не следует путать его с нашатырем – хлоридом аммония и состоящим из него минералом. У многих слово «нашатырь» ассоциируется именно с нашатырным спиртом. Это пищевая добавка Е510, но в этом качестве крайне редко используется.
Для азотной подкормки и борьбы с вредителями на огороде и даче используется 10% водный раствор аммиака, иначе это и есть нашатырный спирт. Однако, используют его не в чистом виде, его перед применением нужно разводить в воде. Однако, для каждого растения и в зависимости от цели применения препарат используется по-разному. Вот об этом и пойдет сегодня речь.
Вот об этом и пойдет сегодня речь.
Нашатырный спирт – как удобрение в саду и огороде
Азот, как химический элемент, крайне важен для развития и роста растений, особенно в начале вегетации. Он задевает все жизненно важные процессы в растении – питание и обмен веществ. Он является важным компонентом в составе клеток, аминокислот, хлорофилла, растительных гормонов, витаминов. И в начале развития молодое растение особенно нуждаются в азоте. Особые соединения азота необходимы для хорошего роста рассады и листьев. Растения, которые получают достаточное количество азота, имеют красивую зеленую окраску листьев, лучше развиваются. Со временем потребность в этом микроэлементе снижается, и на первый план выходят фосфорно-калийные удобрения.
Роль азота заключается еще в том, что он напрямую влияет на качество и количество урожая. Судите сами, от плохого и чахлого растения едва ли вы дождетесь хорошего урожая. Поэтому, начиная с ранней весны, необходимо уже заботится о том, каков будет урожай к осени. И если по каким-то причинам вы не можете обеспечить подкормку органическими или минеральными азотными удобрениями, вам на помощь придет нашатырный спирт.
И если по каким-то причинам вы не можете обеспечить подкормку органическими или минеральными азотными удобрениями, вам на помощь придет нашатырный спирт.
Резкий запах аммиака крайне неприятен для вредителей. Поэтому водные растворы помогут избавиться от таких злостных насекомых, как тля, скрытнохоботник, муравьи, которые являются разносчиками тли, а также медведка, колорадский жук и др.
Однако, при работе с растворами аммиака необходимо соблюдать осторожность. Поскольку это ядовитое летучее вещество, при вдыхании средство вызывает сильное раздражение и даже ожоги слизистых оболочек, работать с ним надо в респираторах или на открытом воздухе. Помните также, что это взрывоопасное вещество и разводить его нужно только вдали от открытых источников огня.
Применение нашатырного спирта для подкормки лука и чеснока
Признаками нехватки азота у лука и чеснока является пожелтение их листьев. Это происходит по следующим причинам:
- Последствия возвратных заморозков,
- Нехватка питания (азота),
- Наличие вредителей, которых у луковичных растений очень много, но чаще всего это луковая муха.

Если листья у лук или чеснока пожелтели от заморозков, реанимировать их можно с помощью антистрессовых препаратов – Циркона, Эпина или перекиси водорода.
Нехватку азота можно восполнить подкормкой зеленого удобрения или мочевиной. Обычно к этому времени уже есть крапива и сорняки, из них вполне можно приготовить питательную подкормку. Но если такой возможности нет воспользуйтесь раствором аммиака. Но помните, что пользоваться азотными подкормками следует тогда, когда температур окружающего воздуха поднимется выше +10ºС, иначе просто усвоение питательных веществ не будет происходить.
Подкормку проводят расчетом, приготовленным из расчета 2 ст. л. на 10 л воды. Подкармливают только по влажной почве, то есть необходимо сначала пролить грядки простой водой, и только после этого поливают по листу разведенным раствором. Или это делают после дождя.
Одновременно с подкормкой проводят борьбу с вредителями, которых у лука очень много. Самые злостные из них луковая муха и скрытнохоботник. Лучше всего лук (севок) садить поздней осенью под зиму. Весной лук рано пускает перо,у него быстро развивается корневая система, поэтому луковая муха к моменту лета не имеет возможности откладывать личинки в донце луковицы. С профилактической целью хорошо полить грядки раствором нашатырки. Для этого 2 ст. л. разводят в 10 л воды и поливают по кусту. Обработку надо провести не менее 3 раз с интервалом в 10 дней.
Лучше всего лук (севок) садить поздней осенью под зиму. Весной лук рано пускает перо,у него быстро развивается корневая система, поэтому луковая муха к моменту лета не имеет возможности откладывать личинки в донце луковицы. С профилактической целью хорошо полить грядки раствором нашатырки. Для этого 2 ст. л. разводят в 10 л воды и поливают по кусту. Обработку надо провести не менее 3 раз с интервалом в 10 дней.
Как применять нашатырный спирт от вредителей на капусте
Самыми злостными вредителями на капусте, когда она начинает завязываться в кочаны – слизни. Это сухопутные брюхоногие моллюски питаются только сочными молодыми частями растений, любят капусту и клубнику. Особенно из много плодится в сырое и дождливое лето. Они способны не только уничтожить урожай, но и занести вирусы и бактерии. Есть много методов борьбы со слизнями, но здесь хочу уделить внимание на обработки с помощью нашатырного спирта.
Для наведения рабочего раствора в 1 л воды добавляют 1 ч. л. раствора аммиака. Размешивают и полученным раствором обрабатывают капусту, стараясь их опрыскивать сверху и с нижней стороны листьев. Повторные обработки проводят не ранее, чем через 10 дней еще 2 раза. Не забудьте посыпать почву вокруг кочанов древесной золой или яичной скорлупой. Слизни не смогут проползти через них, не поранив свои нежные брюшки. Это тоже их отпугнет.
Размешивают и полученным раствором обрабатывают капусту, стараясь их опрыскивать сверху и с нижней стороны листьев. Повторные обработки проводят не ранее, чем через 10 дней еще 2 раза. Не забудьте посыпать почву вокруг кочанов древесной золой или яичной скорлупой. Слизни не смогут проползти через них, не поранив свои нежные брюшки. Это тоже их отпугнет.
В качестве подкормки едва ли поможет нашатырный спирт, поскольку в момент завязывания кочанов, это уже будет не так актуально.
Применение нашатырного спирта для клубники
Как ухаживать за клубникой ранней весной, я уже рассказывала. Но хочу обратить внимание на подкормку и обработку от вредителей, в первую очередь от земляничного долгоносика с помощью нашатырного спирта.
В одном из источников было сказано, что азот клубника усваивает слабо. Но зато как предохранительное средство от долгоносика, муравьев и слизней раствор аммиака просто не заменим. Причем, обработку проводят по мульче, поскольку в ней, особенно в скошенной траве могут тоже быть вредители. Рабочий раствор готовят из расчета 2 ст. л. 10% раствора аммиака на 10 л воды, хорошо перемешивают и поливают грядку всплошную. На грядку длиной в 5 метров, должно уйти не менее 10 л раствора. Обработку клубники проводят по влажной земле после полива или дождя.
Рабочий раствор готовят из расчета 2 ст. л. 10% раствора аммиака на 10 л воды, хорошо перемешивают и поливают грядку всплошную. На грядку длиной в 5 метров, должно уйти не менее 10 л раствора. Обработку клубники проводят по влажной земле после полива или дождя.
Подкармливать и обрабатывать от вредителей клубнику во время цветения и плодоношения не рекомендуется. Но после сбора урожая кустики можно провести еще одну подкормку.
Подкормка нашатырным спиртом рассады помидоров, огурцов и перцев
Высаживая рассаду помидоров, огурцов и перцев в неотапливаемую теплицу, даже из поликарбоната, она испытывает сильный стресс, когда возникает угроза возвратных заморозков. При низких ночных температурах азот из почвы не может усваиваться растениями, поэтому они отстают в росте, у них желтеют листья. Поэтому, как только погода установится, и угроза заморозков исчезнет, растения в теплице необходимо срочно подкормить. И первую азотную подкормку лучше всего провести опрыскиванием раствором аммиака.
Уже после первой подкормки вы заметите преображение растений: листья приобретут насыщенный зеленый цвет, начнется активный рост растения. Такая подкормка дает сильный толчок для роста и развития растения. Кроме того, это прекрасное средство от вредителей, которых и в теплице тоже не мало. Это тля, галловая нематода, табачные трипсы, мокрицы и слизни и т. д.
Для первой подкормки разведите 2 ст. л. раствора аммиака на 10 л воды, если используете 10% раствор, и 1 ст. л., если концентрация исходного препарата 25%. Хорошо размешиваем рабочий раствор и поливаем по влажной земле разведенным раствором из расчета 1 л на каждый куст.
Всего в начале вегетации нужно провести 2-3 подкормки, но до начала цветения и плодоношения. Увлекаться такой подкормкой тоже не следует, иначе растения зажируют и вся сила уйдет на рост ботвы. Не забудьте через 10-12 дней после азотной подкормки провести подкормку калийными удобрениями.
Как разводить нашатырный спирт от вредителей
Тля – это кошмарное зло практически для всех растений в саду и огороде. Существует около 1,5 тысяч представителей опасного вредителя, которые могут испортить весь урожая смородины, крыжовника, яблонь, вишни, клубники, винограда, многих овощных (капуста, огурцы, морковь, томаты) и цветочных культур (розы, клематисы) и еще многих других культур.
Существует около 1,5 тысяч представителей опасного вредителя, которые могут испортить весь урожая смородины, крыжовника, яблонь, вишни, клубники, винограда, многих овощных (капуста, огурцы, морковь, томаты) и цветочных культур (розы, клематисы) и еще многих других культур.
Насекомые питаются соком молодых листочков и побегов, вызывая их обезвоживание и последующую гибель. На листочках появляется сладкий липкий налет, вызывающий грибковые поражения. Кроме того, этот налет привлекает муравьев, которые потом являются переносчиками грибковых инфекций и этой же тли.
Порой огородникам приходится приложить немало усилий, чтобы избавиться и от тли, и от муравьев. Одним из способов борьбы с ними является опрыскивание раствором нашатырного спирта. Для этого, как только стает снег, до начала цветения нужно обильно опрыскать растения следующим составом:
- жидкое зеленое мыло – 3 ст. л.,
- 10% раствор аммиака – 1,5-2 ст. л.
Смешайте компоненты и очень обильно опрыскайте при помощи мелкого разбрызгивателя листочки со всех сторон, буквально смывайте насекомых. Обработку проводите каждые 1,5-2 недели 3 раза. Успейте это сделать до начала цветения растений.
Обработку проводите каждые 1,5-2 недели 3 раза. Успейте это сделать до начала цветения растений.
А от муравьев сделайте состав из зеленого мыла, уксуса и растительного масла, и полейте этим составом почву вокруг кустов и деревьев.
Борьба с медведкой с помощью нашатырного спирта – это старый проверенный способ. Принцип действия заключается в том, что вредитель не переносит резкие запахи и уходит с этих мест. Для приготовления раствора в 10 л воды растворяют 3 ст. л. 10% раствора аммиака (или 10 мл). Рабочим раствором поливают междурядья. Дозировку нужно строго соблюдать, иначе можно навредить и самому растению.
Можно смочить тряпочки концентрированным (10%) раствором и засунуть их в ходы, где обитает медведка. А чтобы запах долго не выветривался, тряпочки можно положить в полиэтиленовый пакет, проколоть в нем несколько отверстий и положить в ходы-туннели.
Нашатырный спирт для комнатных цветов
Пересадив комнатные растения в питательный субстрат, запаса питательных веществ ему хватает максимум на 2 месяца. Полезные вещества поглощаются растениями, а часть из них вымывается из горшка через дренажные отверстия при поливе. Недостаток азота у комнатных цветов приводит к тому, что листья теряют насыщенный зеленый цвет, молодые листья желтеют и отмирают, растения теряют способность к цветению. Растения не могут сопротивляться болезням и вредителям. Комнатные цветы испытывают недостаток питания и больше всего они нуждаются в азоте. Если у растения не наступает период покоя, то оно требует постоянных подкормок во время роста и цветения.
Полезные вещества поглощаются растениями, а часть из них вымывается из горшка через дренажные отверстия при поливе. Недостаток азота у комнатных цветов приводит к тому, что листья теряют насыщенный зеленый цвет, молодые листья желтеют и отмирают, растения теряют способность к цветению. Растения не могут сопротивляться болезням и вредителям. Комнатные цветы испытывают недостаток питания и больше всего они нуждаются в азоте. Если у растения не наступает период покоя, то оно требует постоянных подкормок во время роста и цветения.
Простой и эффективный способ спасти растения, это полить их раствором нашатырного спирта, обеспечив их необходимым количеством азота. Для этого сделайте раствор в таких пропорциях (на выбор в зависимости от нужного объема жидкости):
- на 10 л воды – 5 ст. л. нашатырки, или
- на 5 л воды – 1,5-2 ст. л. раствора аммиака, или
- на 1 л воды – 1 чайная или 1 десертная ложка.
Размешайте хорошо рабочий раствор и полейте растение. Сколько налить воды, зависит от объема горшка и возраста растения, но не более 25 мл на маленькое и не более 200 мл – на больше растение.
Сколько налить воды, зависит от объема горшка и возраста растения, но не более 25 мл на маленькое и не более 200 мл – на больше растение.
Комнатные растения также страдают от тли, которую, скорее всего, заносят с садовой почвой. Для борьбы с тлей и мошками наведите раствор: на 2 л воды добавьте 3 ст. л. нашатырки. Обработки проводите 1 раз в 7-10 дней, пока не исчезнет проблема. Для обработки почвы от мошек-дрозофил обработайте раствором 1 ст. л препарата на 1 л воды.
И еще один важный момент. Перед тем, как посадить растение в новый горшок, не забудьте его продезинфицировать горячим раствором нашатырного спирта. Для этого натрите 100 г хозяйственного мыла, растворите стружку в 5 л горячей воды и добавьте 60 мл 10% раствора аммиака. Раствор тщательно размешайте, промойте им горшки и хорошо прополощите под проточной водой.
В заключение хочу сказать, что нашатырный спирт — не панацея. Это всего лишь один из вариантов решения какой-то проблемы в саду или огороды. Все-таки аммиак — ядовитое вещество и оно может быть губительным при чрезмерном его употреблении. По возможности выбирайте альтернативные способы подкормки растений и борьбы с вредителями. И очень рекомендую к просмотру это видео.
По возможности выбирайте альтернативные способы подкормки растений и борьбы с вредителями. И очень рекомендую к просмотру это видео.
Желаю хороших урожаев!
Аммиак | CADDIS Том 2
Обзор
Рисунок 1. Пруд-отстойник. Аммиак (NH 3 ) — распространенный токсикант, получаемый из отходов (см. Рисунок 1), удобрений и природных процессов. Аммиачный азот включает как ионизированную форму (аммоний, NH 4 + ), так и неионизированную форму (аммиак, NH 3 ). Увеличение pH способствует образованию более токсичной неионизированной формы (NH 3 ), тогда как снижение способствует образованию ионизированной (NH 4 + ) формы. Температура также влияет на токсичность аммиака для водных организмов.
Температура также влияет на токсичность аммиака для водных организмов.
Аммиак — частая причина гибели рыб. Однако наиболее распространенные проблемы, связанные с аммиаком, связаны с повышенными концентрациями, влияющими на рост рыб, состояние жабр, вес органов и гематокрит (Milne et al. 2000). Продолжительность и частота воздействия сильно влияют на тяжесть последствий (Milne et al. 2000).
Аммиак в отложениях обычно возникает в результате бактериального разложения органических веществ, которые накапливаются в отложениях.Микробиота донных отложений минерализует органический азот или (реже) производит аммиак путем диссимиляционного восстановления нитратов. Аммиак особенно распространен в бескислородных отложениях, потому что нитрификация (окисление аммиака до нитрита [NO 2 — ] и нитрата [NO 3 — ]) ингибируется. Аммиак, образующийся в донных отложениях, может быть токсичным для бентической или поверхностной водной биоты (Lapota et al. 2000).
2000).
Аммиак также вызывает биохимическую потребность в кислороде для водоприемников (это называется азотной биологической потребностью в кислороде или NBOD).Это происходит потому, что растворенный кислород потребляется, поскольку бактерии и другие микробы окисляют аммиак до нитритов и нитратов. Получающееся в результате снижение растворенного кислорода может уменьшить разнообразие видов и даже вызвать гибель рыбы.
Кроме того, аммиак может привести к сильному росту растений (эвтрофикации) из-за своих питательных свойств (см. Модуль «Питательные вещества»). Водоросли и макрофиты поглощают аммиак, снижая его концентрацию в воде.
Контрольный список источников, данных о местонахождении и биологического воздействия
В этом модуле аммиак рассматривается как непосредственный фактор стресса с токсическим механизмом действия.Его питательные свойства учитываются в модуле «Питательные вещества».
Аммиак должен быть потенциальной причиной, когда человеческие источники и деятельность, наблюдения на месте или наблюдаемые биологические эффекты поддерживают части путей от источника к ухудшению (см. Рисунок 2).
Рисунок 2).
Контрольный список ниже поможет вам определить ключевые данные и информацию, полезные для определения того, следует ли включать аммиак в число возможных причин. Список предназначен для того, чтобы помочь вам в сборе доказательств, подтверждающих, ослабляющих или устраняющих аммиак как возможную причину.
Для получения дополнительной информации о конкретных записях перейдите на вкладку Когда отображать .
Рассмотрите возможность включения аммиака в список возможных причин , если присутствуют следующие источники и виды деятельности, свидетельства на месте и биологические эффекты:
Источники и деятельность
- Водохранилища Рисунок 2 . Простая концептуальная диаграмма, иллюстрирующая причинно-следственные связи, связанные с аммиаком, от источников до нарушений. Щелкните диаграмму, чтобы просмотреть ее в увеличенном виде.
- Отводы для обработки бытовых отходов
- Септическая фильтрация
- Промышленные точечные источники
- Сельскохозяйственные и городские стоки (удобрения)
- Внесение навоза
- Концентрированное кормление животных
- Аквакультура
- Фильтрат свалок
- Атмосферные источники
- Прибрежная девегетация
Свидетельства о местонахождении
- Медленная или стоячая вода
- Плотность рыбы
- Наличие органических отходов
- Неприятный запах
- Наличие органических взвешенных веществ или хлопьев
- Щелочная, бескислородная или теплая вода
- Производство высоких растений (e.
 г., цветение водорослей)
г., цветение водорослей)
Биологические эффекты
- Снижение или отсутствие чувствительных к аммиаку видов
- Физиологические эффекты (например, снижение экскреции азота, снижение связывания кислорода с гемоглобином)
- Поведенческие эффекты (например, потеря равновесия, повышенная возбудимость, учащенное дыхание)
- Морфологические эффекты (например, разрастание жаберных пластинок, уменьшение лимфоидной ткани в селезенке, поражения кровеносных сосудов, секреция слизи)
- Воздействие на организм и население (e.г., снижение роста и численности, массовая смертность)
- Температура: Токсичность аммиака (как общего аммиака) увеличивается с повышением температуры (US EPA 1999).
- pH: Концентрация аммиака и его токсичность возрастают с увеличением pH, хотя требуется меньше аммиака, чтобы вызвать токсический эффект при более низких pH (IPCS 1986, Wurts 2003).

- Растворенный кислород: Кислород расходуется при окислении аммиака (нитрификация), а низкие уровни кислорода повышают уровень аммиака, ингибируя нитрификацию.
- Сезон: Общая концентрация аммиачного азота в поверхностных водах летом обычно ниже, чем зимой. Это происходит из-за поглощения растениями и снижения растворимости аммиака при более высоких температурах воды (IPCS 1986).
- Ионная сила: Толерантность к аммиаку может увеличиваться с увеличением ионной силы или солености (Sampaio et al.2002).
- Отложения: Мелкие отложения, как правило, выделяют аммиак из-за низкого уровня кислорода и высокого содержания органических веществ.
- Концентрации, измеряемые непрерывно в течение долгого времени на объекте, такие же или ниже, чем у аммиака на участках без наблюдаемых биологических нарушений (, отсутствие совпадения, ).

- На территории представлены все стадии жизни чувствительных к аммиаку видов.
Начало страницы
Когда размещать
Источники и действия, которые предполагают включение аммиака в список возможных причин
На количество аммиака в поверхностных водах влияет многие виды деятельности человека в водоемах и связанных с ними водосборах. Чем шире соответствующие источники и виды деятельности, тем больше вероятность того, что аммиак достигнет таких концентраций, которые могут повредить поверхностные воды.
- Запруды : Заполнение водой может способствовать повышению концентрации аммиака.Отсутствие турбулентности и перемешивания уменьшит улетучивание аммиака, что приведет к более высоким концентрациям аммиака ниже по потоку. Термическая стратификация в водохранилищах может приводить к более высоким концентрациям аммиака в гиполимнионе, что в случае дна сбросных дамб может привести к увеличению содержания аммиака в водах ниже по течению.

- Муниципальные очистные сооружения : Муниципальные очистные сооружения и государственные очистные сооружения (POTW) перерабатывают бытовые отходы и работают в соответствии с ограничениями разрешений, разработанными для защиты принимающих водоемов от избыточного поступления загрязняющих веществ, таких как аммиак (Constable et al.2003 г.). Однако во время штормов избыточный сток может быть отведен в комбинированные сливы канализации (CSO), которые сбрасывают неочищенные бытовые отходы непосредственно в ручьи и озера. Авария очистных сооружений также может привести к высоким выбросам аммиака в водотоки (см. Рисунок 3). Рисунок 3 . Сброс со станции очистки сточных вод.
Фото любезно предоставлено USGS Программа гидрологии токсичных веществ Фотогалерея - Просачивание септиков и вышедшие из строя заводы по упаковке : Утечки из вышедших из строя септиков или их участков выщелачивания, а также сбросы из плохо функционирующих комплексных очистных сооружений могут вносить значительные количества аммиака в водотоки и озера.

- Промышленный точечный источник : Некоторые отрасли промышленности выбрасывают аммиак в качестве побочного продукта в потоки отходов. Эти сбросы в конце трубы регулируются с помощью разрешительных лимитов для защиты принимающих водоемов, но если исходная конструкция системы неадекватна или проблемы в эксплуатации приводят к неадекватно очищенным сбросам, в результате возникают повышенные концентрации аммиака. Это особенно актуально для производств, которые производят аммиак, аминированные органические вещества или другие азотсодержащие отходы, такие как пищевая промышленность (например,g., птицеводство, животноводство или морепродукты), фармацевтическое производство (например, процессы ферментации), бумажные фабрики и очистка дымовых газов на угольных электростанциях.
- Сельскохозяйственные и городские стоки : Сток и фильтрат в результате использования удобрений в сельском хозяйстве, рекреационных целях (например, полей для гольфа) или в жилых помещениях могут напрямую увеличить количество аммиака в поверхностных водах (см.
Рисунок 4). Рисунок 4 . Сельскохозяйственный сток.
Фото любезно предоставлено NOAA Ocean Service Education - Внесение навоза : Навоз, содержащий аммиак и другие азотистые соединения, часто разбрасывают по полям, а затем смывают в ручьи и другие водоемы в результате дождя или таяния снега.Выпас скота разбрасывает мочу и навоз на пастбища, а там, где у них есть доступ к ручьям, они вносят мочу и навоз прямо в воду.
- Операции по концентрированному кормлению животных : Сток с откормочных площадок и других операций по концентрированному кормлению животных может содержать высокие уровни аммиака и других азотистых соединений.
- Аквакультура : Дренаж с рыбных и креветочных хозяйств с высоким содержанием аммиака, если не обработать должным образом.
- Свалки : стоки со свалок могут содержать высокие концентрации аммиака (Mancl and Veenhuizen 1991).
- Атмосферные источники : Эти источники включают аммиак, образующийся в результате сельскохозяйственных работ, и выбросы оксидов азота от автомобилей и промышленности (NOAA 2000).
 Это регионально важные источники, но они редко указывают на конкретные нарушения.
Это регионально важные источники, но они редко указывают на конкретные нарушения. - Прибрежная девегетация : Удаление растительности с берегов поверхностных вод увеличивает сток поверхностных вод и температуру воды, а также снижает поступление древесного мусора. Повышенный сток поверхностных вод может увеличить количество аммиака, непосредственно попадающего в водоем.Повышенная температура воды усиливает токсичность аммиака. Уменьшение турбулентности из-за меньшего количества древесных остатков может снизить улетучивание и оксигенацию.
- Высокая продуктивность растений : Высокая продуктивность водорослей или растений может уменьшить аммиак за счет ассимиляции, увеличить аммиак за счет фиксации азота или повысить pH-токсичность за счет поглощения CO 2 , что приведет к переходу на более неионизированный аммиак.
Начало страницы
Свидетельство о местонахождении, которое предполагает включение аммиака в список возможных причин
Рисунок 5 . Водохранилище для борьбы с наводнениями вдоль ручья Лос-Гатос в Кэмпбелле, Калифорния.
Любезно предоставлено USGS В дополнение к наблюдениям за источниками, описанными выше, данные наблюдений на месте могут предполагать, что высокое содержание аммиака должно быть включено в качестве потенциальной причины-кандидата:
Медленно движущаяся вода : Медленно движущаяся или стоячая вода (см. Рисунок 5) может иметь высокие концентрации аммиака из-за отсутствия турбулентности и улетучивания и большего накопления метаболических отходов и продуктов разложения, включая аммиак (ВОЗ 1986).
Высокая плотность рыбы : Уменьшение стока может привести к скоплению рыбы в лужах или других убежищах, что приведет к концентрации экскрементов и повышению концентрации аммиака.
Наличие органических отходов : Органические отходы — это остатки любого некогда живого организма или их экскременты. Экскременты и сточные воды содержат большое количество аммиака, поэтому признаки наличия такого материала в водоеме могут указывать на аммиак в качестве возможной причины. Напротив, в растительном материале обычно мало азота, и связанные с ним разложители могут поглощать аммиак и снижать его концентрацию в воде.Определение типа органических отходов, присутствующих в водоеме, поможет выявить возможные причины. Чрезмерное количество органических отходов в воде может привести к появлению сероватого оттенка с видимыми отложениями ила в зонах отложения.
Напротив, в растительном материале обычно мало азота, и связанные с ним разложители могут поглощать аммиак и снижать его концентрацию в воде.Определение типа органических отходов, присутствующих в водоеме, поможет выявить возможные причины. Чрезмерное количество органических отходов в воде может привести к появлению сероватого оттенка с видимыми отложениями ила в зонах отложения.
Неприятный запах : Аммиак в качестве газа имеет характерный резкий запах (вспомните о средствах для мытья окон и полов). Концентрации аммиака в потоках редко бывают достаточно высокими, чтобы проявлять этот запах, но вода с неприятным запахом, запахом септических или органических отходов может иметь относительно высокие концентрации аммиака.
Взвешенные твердые частицы : Взвешенные твердые частицы из сточных вод или стоков могут содержать высокое содержание аммиака или действовать как катализаторы роста бактерий, способствующие накоплению аммиака. Определение типа присутствующего взвешенного материала важно для выявления возможных причин.
Щелочная, бескислородная или теплая вода : Характеристики воды, которые способствуют образованию аммиака (например, аноксия) или повышают токсичность (например, высокий pH и температура), являются признаками того, что причиной может быть аммиак.
Начало страницы
Биологические эффекты, предполагающие включение аммиака в список возможных причин
Юнионизированный аммиак очень токсичен для водных животных, особенно рыб, поскольку он может легко диффундировать через жаберные мембраны (Sampaio et al. 2002). Ионизированный аммиак не так легко проходит через жаберные мембраны, поэтому он значительно менее токсичен, чем неионизированная форма (Camargo and Alonso 2006). У большинства рыб аммиак выводится путем пассивной диффузии аммиака через жабры в соответствии с его градиентом парциального давления (Wilson et al.1998). Нарушение этого градиента вызывает повышение внутренней концентрации аммиака, что влияет на внутренние органы, функцию нервной системы и дыхание.
Уменьшение количества видов и процессов, чувствительных к аммиаку : Лососевые, как правило, особенно чувствительны к острым воздействиям, связанным с эпизодическими источниками. Однако чувствительность к хроническому воздействию менее последовательна с таксономической точки зрения. В частности, наиболее чувствительный род рыб, используемый для определения критерия постоянного качества воды, — это рыба-солнце ( Lepomis spp.) (Агентство по охране окружающей среды США, 1999 г.).
На ранних этапах жизни рыбы более чувствительны, чем молодые или взрослые особи. Следовательно, эффекты более вероятны в те сезоны, когда присутствуют ранние стадии жизни.
Беспозвоночные, особенно членистоногие, обычно менее восприимчивы, чем рыбы. Следовательно, наблюдения о том, что рыбы страдают больше, чем беспозвоночные, согласуются с аммиаком как причиной. Однако недавняя информация свидетельствует о том, что некоторые пресноводные мидии (Unionidae), особенно глохидии и ювенильные стадии, очень чувствительны к аммиаку (Newton and Bartsch 2006).
Объединенный аммиак может вызвать токсичность для бактерий Nitrosomonas и Nitrobacter , подавляя процесс нитрификации. Это ингибирование может приводить к увеличению накопления аммиака в водной среде, повышая уровень токсичности для бактерий и водных животных (Carmargo and Alonso 2006).
Физиологические, морфологические и поведенческие эффекты : Специфические биотические эффекты, предполагающие, что вы считаете аммиак возможной причиной, описаны в таблице 1.Обратите внимание, однако, что наблюдение этих эффектов не подтверждает причинно-следственную связь. В некоторых случаях такой же наблюдаемый эффект может быть вызван другими факторами стресса или несколькими агентами. Если вы подозреваете, что аммиак является причиной наблюдаемых биологических нарушений, также учитывайте pH, температуру и низкий уровень растворенного кислорода — факторы стресса, которые часто связаны с концентрациями аммиака и способствуют их увеличению.
| Эффекты | Номер ссылки |
|---|---|
| Снижение дыхательной функции, вызывающее гипервентиляцию | Lease et al.2003, Твитчен и Эдди 1994, МПХБ 1986 |
| Нарушение функции нервов; Воздействие на периферическую и центральную нервную систему, вызывающее повышенную возбудимость | Sampaio et al. 2002, Твитчен и Эдди 1994, МПХБ 1986 |
| Судороги | Твитчен и Эдди 1994, МПХБ 1986 г. |
| Кома | Твитчен и Эдди 1994, МПХБ 1986 г. |
| Повреждение жаберного эпителия, вызывающее удушье | Lang et al.1987 |
| Разрастание жаберной ткани | Lang et al. 1987 |
| Стимуляция гликолиза и подавление цикла Кребса, вызывая прогрессирующий ацидоз и снижение способности крови переносить кислород | Камарго и Алонсо 2007 |
| Разрыв окислительного фосфорилирования, вызывающий ингибирование продукции АТФ и истощение АТФ в базилярной области мозга | Камарго и Алонсо 2007, Сампайо и др. 2002 2002 |
| Нарушение работы кровеносных сосудов и осморегуляторной активности, вызывающее нагрузку на печень и почки | Камарго и Алонсо 2007, Сампайо и др. 2002, Босаковски и Вагнер 1994 |
| Подавление иммунной системы, вызывающее повышенную восприимчивость к бактериям и паразитарным заболеваниям | Камарго и Алонсо 2007, Сампайо и др. 2002 |
| Снижение Na + до потенциально смертельно низких уровней | Твитчен и Эдди 1994 |
Эффекты на уровне организма и популяции : Вышеуказанные эффекты могут приводить к эффектам на уровне организма и популяции, в том числе:
- Пониженная скорость роста
- Пониженная активность кормления
- Снижение плодовитости и репродуктивного успеха
- Уменьшение численности населения
- Повышенная смертность (e.г., добыча рыбы)
- Повышенная эрозия плавников рыб
Начало страницы
Свидетельства, подтверждающие исключение аммиака в качестве возможной причины
Рекомендации по исключению аммиака в качестве вероятной причины ограничены ситуациями, в которых физические и химические характеристики объекта не позволяют логически объяснить ухудшение качества аммиаком. Таким образом, отсутствие очевидных источников и наблюдений на месте не может быть использовано для исключения аммиака как вероятной причины.Однако отсутствие источников или других доказательств может быть использовано для отсрочки рассмотрения аммиака, если поддерживаются другие возможные причины.
Таким образом, отсутствие очевидных источников и наблюдений на месте не может быть использовано для исключения аммиака как вероятной причины.Однако отсутствие источников или других доказательств может быть использовано для отсрочки рассмотрения аммиака, если поддерживаются другие возможные причины.
Источники : Водосбросы, водопады и турбулентные потоки в ручьях и реках вызывают естественное улетучивание аммиака. Таким образом, высокие концентрации аммиака физически исключаются из-за постоянного улетучивания из-за турбулентности. Однако на концентрацию аммиака повлияет изменение расхода в течение года, и это следует учитывать. В таких случаях обследование следует дополнить измерениями концентрации аммиака.
Наблюдения на объекте : Мы предостерегаем от использования контрольных показателей воздействия для исключения аммиака из первоначального списка возможных причин, потому что разные виды имеют разные толерантности к аммиаку, а концентрации редко хорошо охарактеризованы. В таблице 2 приведены примерные значения токсичности для выбранных видов с острыми и хроническими значениями из текущих критериев качества воды для аммиака (US EPA 1999).
В таблице 2 приведены примерные значения токсичности для выбранных видов с острыми и хроническими значениями из текущих критериев качества воды для аммиака (US EPA 1999).
| Виды | Среднее острое значение (мг N / л) | Среднее значение по хронической токсичности (мг N / л) |
|---|---|---|
| Cladoceran, Daphnia magna | 35,76 | 12,3 |
| Моллюск, Musculium transversum | 35,65 | 2,26 |
| Рыба, Pimephales promelas | 43,55 | 3.09 |
| Канальный сом, Ictalurus punctatus | 34,44 | 8,84 |
| a LC 50 или EC 50 означает b Средние геометрические средние значения NOEC и LOEC при pH = 8, 25 o C | ||
Начало страницы
Способы измерения
Концентрация аммиака в воде измеряется как общий аммиак и обычно указывается в мг / л. Концентрация неионизированного аммиака (NH 3 ) рассчитывается по хорошо известным формулам (см. Ссылку на калькулятор ниже). При различении неионизированного и ионизированного аммиака важно принимать во внимание влияние температуры и pH (Eaton et al. 2005).
- Аммиачный зонд : Измерительный зонд подключен к электронному ионометру, который измеряет и отображает напряжение, возникающее от аммиака, которое затем преобразуется в концентрацию с использованием стандартной кривой.
- Колориметр : Один или несколько реагентов добавляют к образцу через определенные промежутки времени, так что интенсивность получаемого цвета пропорциональна аммиаку, который реагирует с реагентом. Затем это цветовое поглощение измеряют с помощью колориметра или спектрофотометра. Бланки и стандарты используются для построения стандартной кривой, по которой показание абсорбции образца преобразуется в концентрацию аммиака.
Доля неионизированного аммиака (NH 3 ) напрямую не измеряется, а вместо этого рассчитывается с использованием показателей общего аммиака, pH, температуры и ионной силы (измеряется либо в терминах общего количества растворенных твердых веществ, либо в виде проводимости). Американское рыболовное общество разработало для этой цели калькулятор аммиака (следует загрузить таблицу 9 на указанной веб-странице). После ввода необходимых данных инструмент рассчитает количество неионизированного аммиака как в мг / л, так и в мкг / л.
Американское рыболовное общество разработало для этой цели калькулятор аммиака (следует загрузить таблицу 9 на указанной веб-странице). После ввода необходимых данных инструмент рассчитает количество неионизированного аммиака как в мг / л, так и в мкг / л.
Концептуальные схемы
О концептуальных схемах
Концептуальные диаграммы используются для описания предполагаемых взаимосвязей между источниками, стрессорами и биотическими реакциями в водных системах.
Схема простой концептуальной модели
Рисунок 2 .Простая концептуальная диаграмма, иллюстрирующая причинно-следственные связи, связанные с аммиаком, от источников до нарушений. Щелкните диаграмму, чтобы просмотреть увеличенную версию. Многие виды деятельности человека и связанные с ней источники могут способствовать повышению концентрации аммиака в водных системах, что может привести к летальным и сублетальным последствиям для водных организмов. Изменение русла может привести к снижению поглощения азота в потоке, в то время как уменьшение прибрежной и водосборной растительности, связанное с сельским хозяйством и урбанизацией, может снизить поглощение азота в окружающем ландшафте.Изменение русла и забор воды могут снизить улетучивание аммиака из-за изменений скорости и глубины воды.
Источники, связанные с сельским хозяйством, урбанизацией, промышленностью и аквакультурой, также могут напрямую увеличивать поступление аммиака в водные системы через четыре основных пути переноса (или определяемых транспортом источников): ливневые стоки, утечки или фильтрат в источники подземных вод, атмосферные выбросы и осаждения или прямые сброс сточных вод (см. рисунок 6).
Аммиак — ключевой компонент круговорота азота в потоках, где он может растворяться в толще воды или связываться с отложениями.При достаточно высоких концентрациях аммиак может быть токсичным для водных организмов. В целом, неионизированный аммиак (NH 3 ) является наиболее токсичной формой для водной биоты. Относительный вклад неионизированных форм по сравнению с ионизированными в общую концентрацию аммиака зависит от определенных критериев качества воды, в первую очередь от pH: с увеличением pH увеличивается и доля аммиака в неионизированной форме.
Цикл азота в потокахПовышенные концентрации аммиака или колебания в водотоках могут привести к ухудшению состояния, замедлению роста, изменению поведения, повышенной восприимчивости к другим факторам стресса, повышению смертности и снижению репродуктивного успеха затронутой биоты и, в конечном итоге, могут изменить популяцию и структуру сообщества, а также функцию экосистемы (рис. 7). Рис. 7. Иллюстрация путей прохождения азота.
Подробная схема концептуальной модели
Высокие концентрации аммиака в водных системах могут иметь летальные и сублетальные последствия для водных организмов, потенциально изменяя структуру сообщества и функции экосистемы. Эта концептуальная диаграмма (рисунок 8) иллюстрирует связи между стрессорами, связанными с аммиаком (середина диаграммы), деятельностью человека и источниками, которые могут усиливать эти стрессоры (верхняя часть диаграммы), и биологическими реакциями, которые могут возникнуть (нижняя часть диаграммы).
В некоторых случаях также показаны дополнительные шаги, ведущие от источников к факторам стресса, способы действия, ведущие от факторов стресса к реакциям, и другие модифицирующие факторы. Этот рассказ обычно следует схеме сверху вниз, слева направо. Рис. 8. Пример подробной концептуальной схемы для аммиака. Щелкните диаграмму, чтобы просмотреть ее в увеличенном виде.
Связь источников и видов деятельности с приближенными стрессорами
Изменение канала может повысить концентрацию аммиака несколькими способами.Изменения, снижающие сложность каналов (например, трубопроводы или разделение потоков), могут привести к снижению поглощения азота. Загрязнение водотоков может привести к уменьшению улетучивания аммиака перед водохранилищами из-за снижения скорости воды (и увеличения глубины воды). Уменьшение стока воды ниже водохранилищ (или в ручьях, затронутых водозабором) может ограничить доступность среды обитания, скопление биоты и концентрацию отходов, богатых аммиаком.
Многие виды деятельности человека и землепользования также сокращают прибрежную растительность и растительность водосборов, что может снизить количество азота, поглощаемого наземными растениями, и еще больше снизить сложность каналов из-за уменьшения поступления древесного мусора.
Определенные виды деятельности человека и землепользования могут напрямую привести к попаданию аммиака в водные системы, и во многих случаях связанные с аммиаком нарушения наблюдаются только при наличии этих прямых выбросов. Источники, связанные с сельским хозяйством, включают отходы животноводства от операций по концентрированному кормлению животных (CAFO), других животноводческих хозяйств и объектов аквакультуры, а также удобрения, внесенные в поля. Источники, связанные с городским и пригородным развитием, включают удобрения, вносимые для полей для гольфа и газонов; отходы жизнедеятельности человека из канализационных и септических систем и очистных сооружений; отходы полигонов; и выбросы азотных транспортных средств.
Отрасли промышленности (например, угольные электростанции и другие промышленные объекты) также могут выделять аммиак в окружающую среду. Аммиак из этих источников может поступать в водные системы четырьмя основными путями переноса (или источниками, определяемыми транспортом): ливневые стоки, утечки или фильтрация в источники подземных вод, атмосферные выбросы и осаждения или прямые сбросы сточных вод. Каждый из этих определяемых переносом источников может привести к увеличению поступления аммиака в поверхностные воды.
В потоках аммиак может растворяться в толще воды или быть связан с отложениями.В нетоксичных концентрациях аммиак действует как питательное вещество и может стимулировать производство микробов и растений (дополнительную информацию об этих путях см. В модуле по питательным веществам). Концентрация аммиака также будет зависеть от азотного цикла или превращения азота между различными состояниями окисления. Этот цикл зависит от микробной активности и уровней растворенного кислорода, поэтому эти факторы играют важную роль в определении концентрации аммиака.
При достаточно высоких концентрациях аммиак может быть токсичным для водных организмов.В целом, неионизированный аммиак (NH 3 ) является наиболее токсичной формой для водной биоты. Относительный вклад неионизированных форм по сравнению с ионизированными в общую концентрацию аммиака зависит от определенных критериев качества воды, в первую очередь от pH: с увеличением pH увеличивается и доля аммиака в неионизированной форме. Стрессовые факторы, такие как ионная сила и температура, также могут влиять на токсичность аммиака, поскольку они влияют на переносимость и токсичность аммиака.
Связь ближайших стрессоров с биологической реакцией
Когда концентрация или колебания аммиака в ручьях увеличиваются, концентрация аммиака в водных организмах может возрасти из-за уменьшения выделения азота и увеличения диффузии аммиака через жаберные мембраны.Повышение внутренней концентрации аммиака может иметь несколько пагубных последствий, включая снижение иммунной, осморегуляторной, нервной системы и дыхательной функции. Например, скорость оттока Na + повышается в присутствии аммиака, и рыба должна увеличивать приток Na + , чтобы оставаться в балансе Na + .
Все эти различные способы действия могут способствовать ухудшению состояния, замедлению роста, изменению поведения и повышенной восприимчивости к другим стрессорам в пораженной биоте.Например, повышенная концентрация аммиака может привести к увеличению повреждения жабр и органов, усилению эрозии плавников или увеличению секреции слизи у рыб; возможные изменения в поведении включают повышенную возбудимость, гипервентиляцию и судороги.
В конечном итоге эти эффекты могут привести к изменениям в структуре населения и сообществ, а также к функциям экосистемы. Например, количество таксонов, особенно чувствительных к неионизированному аммиаку, таких как мидии и рыбы, может уменьшиться, в то время как более устойчивые организмы станут более доминирующими.
Начало страницы
Обзоры литературы
В этом разделе представлена аннотированная библиография ссылок, содержащих информацию о взаимосвязи стрессора и реакции на аммиак, а также общую справочную информацию. Это не значит, что это исчерпывающая библиография ссылок, касающихся аммиака, а скорее предназначена для выделения нескольких ссылок, которые могут быть особенно полезными.
- Камарго Дж., Алонсо А. (2006) Экологические и токсикологические эффекты загрязнения неорганическим азотом в водных экосистемах: глобальная оценка.Environment International 32: 831-849.
В данной статье рассматриваются три основных эффекта загрязнения неорганическим азотом в виде NH 4 + , NH 3 , NO 2 — , HNO 2 и NO 3 -, в деталях: подкисление пресноводных экосистем без большой кислотонейтрализующей способности, распространение первичных продуцентов, вызывающих эвтрофикацию, и токсичность для водных позвоночных и беспозвоночных. В документе также описываются риски для здоровья человека и экономики, связанные с загрязнением неорганическим азотом.
- Камарго Дж., Алонсо А. (2007) Загрязнение водных экосистем неорганическим азотом: причины и последствия. Сайт «Энциклопедия Земли».
В этом документе обсуждаются последствия увеличения загрязнения неорганическим азотом. В документе объясняется подкисление пресноводных экосистем, эвтрофикация, токсичные водоросли, токсичность неорганического азота в форме NH 4 + , NH 3 , NO 2 — и NO 3 — , к водным организмам и его неблагоприятному воздействию на здоровье человека.
- Клемент Б., Мерлин Г. (1995) Вклад аммиака и щелочности в токсичность сточных вод со свалок для ряски. Наука об окружающей среде в целом 170: 71-79.
В данном исследовании используются испытания на токсичность, чтобы определить, являются ли аммиак и щелочность основными факторами токсичности фильтрата полигона для ряски. Образцы фильтрата полигонов собираются и используются в тестах на токсичность с различными значениями pH. Кроме того, некоторые пробы фильтрата были очищены от аммиака и использованы для определения эффектов, вызванных аммиаком.
- Констебль М., Чарльтон М., Дженсен Ф., Макдональд К., Крейг Г., Тейлор К. (2003) Оценка экологического риска аммиака в водной среде. Оценка рисков для человека и окружающей среды 9 (2): 527-548.
Этот документ представляет собой тематическое исследование, в котором изучается возможность летального и сублетального воздействия на смесь позвоночных и беспозвоночных в пресноводных водоемах Канады. И в Ред-Ривер, и в гавани Гамильтон есть множество сбросов муниципальных очистных сооружений, и в прошлом они демонстрировали высокий уровень аммиака.В документ включены несколько моделей риска для водных сообществ, которые были разработаны для демонстрации чувствительности видов к аммиаку.
- Diamond J, Mackler D, Rasnake W, Gruber D (1993) Выведение критериев аммиака для конкретного участка для верхнего потока с преобладанием стоков. Экологическая токсикология и химия 12: 649-658.
В этой статье рассматривается диапазон чувствительности к аммиаку для нескольких видов позвоночных и беспозвоночных, населяющих восточный берег Соединенных Штатов.В исследовании изучалось влияние pH и температуры на токсичность аммиака для местных видов.
В этом документе подробно обсуждаются основные свойства, источники и влияние аммиака на водную среду Канады.
В этом документе дается общий подробный обзор аммиака. Его темы варьируются от химических свойств до воздействия на окружающую среду и человека.
- Скотт Д., Лукас М., Уилсон Р. (2005) Влияние высокого pH на ионный баланс, выделение азота и поведение пресноводных рыб из эвтрофного озера: лабораторные и полевые исследования.Водная токсикология 73: 31-43.
В этой статье основное внимание уделяется влиянию летнего цветения цианобактерий и повышения pH в пресноводном гиперэвтрофном озере Слэптон-Лей на нелосальмонидные виды рыб. Было указано, что летнее цветение цианобактерий и повышение pH связаны с усилением воздействия сельского хозяйства и очистных сооружений, отчасти из-за NH 3 .
- Stumm W, Morgan JJ (1996) Aquatic Chemistry. Wiley-Interscience, Нью-Йорк, штат Нью-Йорк.
Этот стандартный текст по лимнохимии дает хорошее объяснение химического состава аммиака в поверхностных водах.
Этот документ представляет собой обновленную версию критериев качества окружающей воды на содержание аммиака 1998 года. В нем рассматривается острая и хроническая токсичность аммиака для пресноводных организмов.
- Вебстер Дж., Малхолланд П., Танк Дж., Валетт М., Доддс В., Петерсон Б., Боуден В., Дам С., Финдли С., Грегори С., Гримм Н., Гамильтон С., Джонсон С., Марти Е., Макдауэлл В., Мейер Дж., Morrall D, Thomas S, Wollheim W (2003) Факторы, влияющие на поглощение аммония в ручьях: межбиомная перспектива.Пресноводная биология 48: 1329-1352.
В этой статье обсуждается эксперимент Lotic Intersite Nitrogen eXperiment (LINX), целью которого было выяснить, как различные физические, химические и биологические процессы в потоках влияют на поглощение аммония. В ходе исследования было изучено 11 участков водотока, от Аляски до Пуэрто-Рико. На каждом участке аммоний вводился в верхнем течении участка исследования. Затем были собраны пробы по времени на участке ниже по течению, и были сопоставлены данные из всех 11 регионов.
- Webster J, Swank W (1985) Факторы, влияющие на перенос биогенных веществ из засаженных лесом и вырубленных водосборов. в: Blackmon R (Eds). Труды лесничего и качества воды: симпозиум Среднего Юга. Университет Арканзаса.
В этой статье описывается поглощение питательных веществ посредством автотрофных и гетеротрофных процессов, образование макробеспозвоночных частиц и удержание растворенных и твердых частиц питательных веществ древесными остатками. Основное внимание в исследовании уделяется влиянию лесозаготовок и, как следствие, изменению физических характеристик водотока на поступление и поглощение питательных веществ.
Начало страницы
Список литературы
- Bosakowski T, Wagner EJ (1994) Исследование эрозии плавников форели, качества воды и условий выращивания на государственных рыбопитомниках в Юте. Журнал Всемирного общества аквакультуры 25 (2): 308-316.
- Камарго Дж., Алонсо А. (2006) Экологические и токсикологические эффекты загрязнения неорганическим азотом в водных экосистемах: глобальная оценка. Environment International 32: 831-849.
- Камарго Дж., Алонсо А. (2007) Загрязнение водных экосистем неорганическим азотом: причины и последствия.Сайт «Энциклопедия Земли».
- Клемент Б., Мерлин Г. (1995) Вклад аммиака и щелочности в токсичность сточных вод со свалок для ряски. Наука об окружающей среде в целом 170: 71-79.
- Констебль М., Чарльтон М., Дженсен Ф, Макдональд К., Крейг Г., Тейлор К. (2003) Оценка экологического риска аммиака в водной среде. Оценка рисков для человека и окружающей среды 9 (2): 527-548.
- Diamond J, Mackler D, Rasnake W, Gruber D (1993) Выведение критериев содержания аммиака для конкретного участка для верхнего потока с преобладанием стоков.Экологическая токсикология и химия 12: 649-658.
- Eaton AD, Clesceri LS, Rice EW, Greenberg AE, Franson MAH (Eds.) (2005) Стандартные методы исследования воды и сточных вод (21-е издание). Американская ассоциация общественного здравоохранения, Вашингтон, округ Колумбия.
- Environment Canada and Health Canada (2001) Отчет об оценке списка приоритетных веществ для аммиака в водной среде. Выйти из министра общественных работ и государственных услуг Канады.
- IPCS (Международная программа по химической безопасности) (1986) Критерии гигиены окружающей среды 54: Аммиак.Выход из Объединенной национальной программы по окружающей среде, Международной организации труда, Всемирной организации здравоохранения.
- Lang T, Peters G, Hoffman R, Meyer E (1987) Экспериментальные исследования токсичности аммиака: влияние на частоту вентиляции, рост, эпидермальные слизистые клетки и структуру жабр радужной форели Salmo gairdneri. Болезни водных организмов 3: 159-167.
- Lapota D, Duckworth D, Ward J (2000) Смешивающие факторы в токсикологии отложений — выпускные документы 1-19.Центр космических и военно-морских систем войны, Сан-Диего, Калифорния.
- Lease H, Hansen J, Bergman H, Meyer J (2003) Структурные изменения в жабрах присосок Lost River, подвергнутых воздействию повышенных pH и концентраций аммиака. Сравнительная биохимия и физиология, Часть C 134: 491-500.
- Mancl K, Veenhuizen M (1991) Как избежать загрязнения водотока из навоза животных. Расширение государственного университета Огайо. AEX-708-91.
- Milne I, Seager J, Mallett M, Sims I (2000) Влияние кратковременного импульсного воздействия аммиака на рыбу.Экологическая токсикология и химия 19 (12): 2929-2936.
- Newton N, Bartsch M (2006) Смертельное и сублетальное воздействие аммиака на молодь Lampsilis мидий (Unionidae) в отложениях и только в воде. Экологическая токсикология и химия 26: 2057-2065.
- NOAA (2000) Атмосферный аммиак: источники и судьба. Обзор текущих федеральных исследований и будущих потребностей (PDF). Комитет по окружающей среде и природным ресурсам, Подкомитет по исследованию качества воздуха.19 с.
- Сампио Л., Василески В., Миранда-Филхо К. (2002) Влияние засоления на острую токсичность аммиака и нитратов для молоди Mugil platanus . Бюллетень загрязнения окружающей среды и токсикологии 68: 668-674.
- Скотт Д., Лукас М., Уилсон Р. (2005) Влияние высокого pH на ионный баланс, выделение азота и поведение пресноводных рыб из эвтрофного озера: лабораторные и полевые исследования. Водная токсикология 73: 31-43.
- Stumm W, Morgan JJ (1996) Aquatic Chemistry.Wiley-Interscience, Нью-Йорк, штат Нью-Йорк.
- Twitchen I, Eddy F (1994) Сублетальные эффекты аммиака для пресноводных рыб. в: Muller R, Lloyd R (Eds). Сублетальное и хроническое воздействие загрязнителей на пресноводных рыб. Книги новостей ФАО и рыболовства, Оксфорд, Великобритания.
- Агентство по охране окружающей среды США (1999 г.) 1999 г. Обновление критериев качества окружающей воды по аммиаку. Агентство по охране окружающей среды США, Вашингтон, округ Колумбия. EPA-822-R-99-014. 153 с.
- Вебстер Дж., Малхолланд П., Танк Дж., Валетт М., Доддс В., Петерсон Б., Боуден В., Дам С., Финдли С., Грегори С., Гримм Н., Гамильтон С., Джонсон С., Марти Е., МакДауэлл В., Мейер Дж., Морралл D, Thomas S, Wollheim W (2003) Факторы, влияющие на поглощение аммония водотоками: межбиомная перспектива.Пресноводная биология 48: 1329-1352.
- Webster J, Swank W (1985) Факторы, влияющие на перенос биогенных веществ из засаженных лесом и вырубленных водосборов. в: Blackmon R (Eds). Труды лесничего и качества воды: симпозиум Среднего Юга. Университет Арканзаса.
- Wilson J, Iwata K, Iwama G, Randall D (1998) Ингибирование выделения и производства аммиака радужной форелью во время сильного щелочного воздействия. Сравнительная биохимия и физиология, Часть B 121: 99-109.
- Wurts W (2003) Суточный цикл pH и токсичность аммиака.Мировая аквакультура 34 (2): 20-21.
Контакты: Авторы и участники
Начало страницы
Аммиак
Аммиак — это бесцветное, едкое газообразное соединение водорода и азота, которое хорошо растворяется в воде. Это биологически активное соединение, обнаруженное в большинстве водоемов как обычный продукт биологического разложения азотистого органического вещества (белка). Он также может попасть в грунтовые и поверхностные воды через сброс промышленных отходов, содержащих аммиак и удобрения.Аммиак используется в муниципальных системах очистки более 70 лет для продления эффективности дезинфекции хлора, добавляемого в питьевую воду. Добавление аммиака усиливает образование хлораминов (которые могут вызывать неприятный привкус) и снижает образование побочных продуктов хлорирования, которые могут быть канцерогенными. Частичная адсорбция хлораминов (из городской воды) GAC может привести к высвобождению аммиака.
Аммиак (Nh4) | Зависит от pH: | Уровни действий Агентства по охране окружающей среды США или руководящие принципы ВОЗ не установлены. |
Источники загрязнения | Дезинфекция хлорамином | |
Возможное воздействие на здоровье | Не предлагается для человека, но токсичен для водных организмов. | |
Методы лечения Пункт въезда (POE) | Ионный обмен с цеолитом | |
* Максимальный уровень загрязнения (MCL) — Максимальный допустимый уровень загрязнения питьевой воды.MCL устанавливаются настолько близко к MCLG, насколько это возможно, с использованием наилучшей доступной технологии лечения и с учетом стоимости. MCL являются обязательными стандартами. |
Щелкните здесь, чтобы открыть Технический информационный бюллетень WQA по аммиаку.
Щелкните здесь, чтобы получить доступ ко всем техническим информационным бюллетеням WQA.
Свойства и способы использования аммиака
Свойства аммиака:
Бесцветный газ с сильным удушающим запахом.Он менее плотен, чем воздух, и реагирует с газообразным хлористым водородом с образованием белого дыма.
NH 3 + HCl NH 4 Cl
Эту реакцию также можно использовать для проверки аммиака.
Аммиак растворим в щелочах — реагирует с кислотами с образованием солей.
NH 3 HNO 3 NH 4 NO 3 (водн.)
Процесс Хабера:
Процесс Хабера используется для производства аммиака.
Азот и водород взаимодействуют вместе в присутствии железного катализатора (Fe 2 O 3 ) с образованием аммиака.
Уравнение:
N 2 + 3H 2 2NH 3
Источником азота является воздух — фракционное растворение воздуха.
Источником водорода является метан CH 4 — реакция CH 4 с паром.
Это обратимая химическая реакция, которая не проходит до 100%.
Используемый катализатор — (Fe 2 O 3 ). Он только ускоряет реакцию, но не влияет на ее выход.
Условия:
Температура 450С
Давление 200 атм.
Аммиак как удобрение:
Растения нуждаются в азоте, так как некоторые компоненты для роста и аммиачные удобрения содержат азот для этого.
Удобрения — это любые вещества, которые добавляют в почву, чтобы сделать ее более плодородной. Растениям нужен N 2 для производства хлорофилов и белков и, следовательно, увеличения общего урожая.
Некоторые обычные удобрения:
Нитрат аммония (NH 4 NO 3 )
Сульфат калия (K 2 SO 4 )
Сульфат аммония (NH 4 ) 2 SO 4
Фосфат аммония (NH 4 ) 3 PO 4
Реакция производства удобрений:
NH 3 + HNO 3 NH 4 NO 3
2NH 3 + H 2 SO 4 (NH 4 ) 2 SO 4
Сравнение содержания азота:
Различные удобрения сравниваются, чтобы увидеть, какое удобрение содержит больше азота.
Давайте сравним сульфат аммония (NH 4 ) 2 SO 4 с мочевиной (NH 2 ) 2 CO
Сульфат аммония (NH 4 ) 2 SO 4 :
21,2% азота
Мочевина (NH 2 ) 2 CO:
46,7% азота
Следовательно, Мочевина (NH 2 ) 2 CO — лучшее удобрение, поскольку оно содержит больше азота.
Эвтрификация:
Нитраты хорошо растворяются в воде. Следовательно, при использовании в качестве удобрения для сельскохозяйственных культур чрезмерное количество нитратов попадает с водой в реки и каналы. Нитраты полезны для роста водорослей. Водоросли покрывают всю территорию, блокируя солнечный свет и кислород для водных растений и живых организмов. Более того, если эту воду выпить — ее содержимое смешивается с гемоглобином и может вызвать тяжелое заболевание.
Использование аммиака:
- Аммиак используется при производстве удобрений, которые помогают повысить урожайность сельскохозяйственных культур.
- Используется при производстве азотной кислоты.
- Производство взрывчатых веществ и нейлона.
Расслабьтесь от учебы и ПОСМОТРИТЕ эту прекрасную картину с солнечным цветком.
ПОДПИСАТЬСЯ, чтобы научиться рисовать
Связанные
Аммиак — Nh4 — Термодинамические свойства
Удельный объем ( v ), удельная внутренняя энергия ( u ), энтальпия ( h ) и энтропия ( с ) насыщенного и перегретого аммиака — NH 3 — также известен как хладагент 717.
Для полной таблицы со специфической энтропией и свойствами перегрева — поверните экран!
| Свойства при насыщении | Свойства при перегреве ( т — т с ) | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Температура — т с — (41 o C) | Давление | C) | — p s — (бар) | Удельный объем — v i — (м 3 / кг) | Удельная энтальпия | Удельная энтальпия Абс.Температура (50 K) | Абс. Температура (100 K) | |||||||||||||||||||||||||||
| насыщенная жидкость — ч f — (кДж / кг) | насыщенный пар — ч г — (кДж / кг ) | насыщенная жидкость — с f — (кДж / кг · K) | насыщенный пар — с г — (кДж / кг · K) | halpy Specific Entity ч — (кДж / кг) | Удельная энтропия — с — (кДж / кг · К) | Удельная энтальпия — ч — (кДж / кг) | Удельная энтропия ||||||||||||||||||||||||||||
| -50 | 0.4089 | 2,625 | -44,4 | 1373,3 | -0,194 | 6,159 | 1479,8 | 6,592 | 1585,9 | 6,948 | ||||||||||||||||||||||||
| -0,096 | 6,057 | 1489,3 | 6,486 | 1596,1 | 6,839 | |||||||||||||||||||||||||||||
| -40 | 0,7177 | 1,552 | 0 | 1390.0 | 0 | 5,962 | 1498,6 | 6,387 | 1606,3 | 6,736 | ||||||||||||||||||||||||
| -35 | 0,9322 | 1,216 | 0,9322 | 1,216 | 22,3 13979 9292 | 22,3 | 22,3 | 1616,3 | 6,639 | |||||||||||||||||||||||||
| -30 | 1,196 | 0,9633 | 44,7 | 1405,6 | 0,188 | 5.785 | 1517,0 | 6,203 | 1626,3 | 6,547 | ||||||||||||||||||||||||
| -28 | 1,317 | 0,8809 | 53,6 | 1408,5 | 0,21 | 0,224 | 1408,5 | 0,224 | 0,224 | |||||||||||||||||||||||||
| -26 | 1.447 | 0,8058 | 62,6 | 1411,4 | 0,261 | 5,718 | 1524,3 | 6.135 | 1634,2 | 6,477 | ||||||||||||||||||||||||
| -24 | 1,588 | 0,7389 | 71,7 | 1414,3 | 0,297 | 5,686 | 1527,9 6292 | 1527.9 6292 | 1,740 | 0,6783 | 80,8 | 1417,3 | 0,333 | 5,655 | 1531,4 | 6,071 | 1642,2 | 6.411 | ||||||||||||||||
| -20 | 1,902 | 0,6237 | 89,8 | 1420,0 | 0,368 | 5,623 | 1534,8 | 6,039 | 16461,0 | 6,039 | 98,8 | 1422,7 | 0,404 | 5,593 | 1538,2 | 6,008 | 1650,0 | 6,347 | ||||||||||||||||
| -16 | 2.265 | 0,5296 | 107,9 | 1425,3 | 0,440 | 5,563 | 1541,7 | 5,978 | 1653,8 | 6,316 | ||||||||||||||||||||||||
| 5,533 | 1545,1 | 5,948 | 1657,7 | 6,286 | ||||||||||||||||||||||||||||||
| -12 | 2,680 | 0,4521 | 126.2 | 1430,5 | 0,510 | 5,504 | 1548,5 | 5,919 | 1661,5 | 6,256 | ||||||||||||||||||||||||
| -10 | 2,908 | 5,891 | 1665,3 | 6,227 | ||||||||||||||||||||||||||||||
| -8 | 3,153 | 0,3879 | 144,5 | 1435,3 | 0.579 | 5,447 | 1554,9 | 5,863 | 1669,0 | 6,199 | ||||||||||||||||||||||||
| -6 | 3,413 | 0,3599 | 153,6 | 14371 | 153,6 | 14371 | 153,6 | 14371 | 6,171 | |||||||||||||||||||||||||
| -4 | 3,691 | 0,3344 | 162,8 | 1439,9 | 0,647 | 5,392 | 1561.4 | 5,808 | 1676,4 | 6,143 | ||||||||||||||||||||||||
| -2 | 3,983 | 0,3110 | 172,0 | 1442,2 | 0,681 | 1442,2 | 0,681 | 5,365 9029,1 | 5,365 | 0 | 4,295 | 0,2895 | 181,2 | 1444,4 | 0,715 | 5,340 | 1567,8 | 5,756 | 1683.9 | 6,090 | ||||||||||||||
| 2 | 4,625 | 0,2699 | 190,4 | 1446,5 | 0,749 | 5,314 | 1570,9 | 5,731 | 5,731 | 199,7 | 1448,5 | 0,782 | 5,288 | 1574,0 | 5,706 | 1691,2 | 6,040 | |||||||||||||||||
| 6 | 5.346 | 0,2351 | 209,1 | 1450,6 | 0,816 | 5,263 | 1577,0 | 5,682 | 1694,9 | 6,015 | 5,238 | 1580,1 | 5,658 | 1698,4 | 5,991 | |||||||||||||||||||
| 10 | 6,149 | 0,2056 | 227.8 | 1454,3 | 0,881 | 5,213 | 1583,1 | 5,634 | 1702,2 | 5,967 | ||||||||||||||||||||||||
| 12 | 6,585 | 0,914 2386 | 0,1926 | 5,611 | 1705,7 | 5,943 | ||||||||||||||||||||||||||||
| 14 | 7,045 | 0,1805 | 246,6 | 1457,8 | 0.947 | 5,165 | 1588,9 | 5,588 | 1709,1 | 5,920 | ||||||||||||||||||||||||
| 16 | 7,529 | 0,1693 | 256,0 | 1459,5 | 14591 | 5,898 | ||||||||||||||||||||||||||||
| 18 | 8,035 | 0,1590 | 265,5 | 1461,1 | 1,012 | 5,118 | 1594.4 | 5,543 | 1715,9 | 5,876 | ||||||||||||||||||||||||
| 20 | 8,570 | 0,1494 | 275,1 | 1462,6 | 1,044 | 5,095 | 5,095 | 5,095 | 9,134 | 0,1405 | 284,6 | 1463,9 | 1,076 | 5,072 | 1600,0 | 5,499 | 1722.8 | 5,832 | ||||||||||||||||
| 24 | 9,722 | 0,1322 | 294,1 | 1465,2 | 1,108 | 5,049 | 1602,7 | 5,478 | 303,7 | 1466,5 | 1,140 | 5,027 | 1605,3 | 5,458 | 1729,6 | 5,790 | ||||||||||||||||||
| 28 | 10.99 | 0,1173 | 313,4 | 1467,8 | 1,172 | 5,005 | 1608,0 | 5,437 | 1732,7 | 5,770 | 1732,7 | 4,984 | 1610,5 | 5,417 | 1735,9 | 5,750 | ||||||||||||||||||
| 32 | 12,37 | 0,1044 | 332.8 | 1469,9 | 1,235 | 4,962 | 1613,0 | 5,397 | 1739,3 | 5,731 | ||||||||||||||||||||||||
| 34 | 13,11 | 0,0986 342 | 0,0986 342 | 5,3781742,6 | 5,711 | |||||||||||||||||||||||||||||
| 36 | 13,89 | 0,0931 | 352,3 | 1471,8 | 1.298 | 4,919 | 1617,8 | 5,358 | 1745,7 | 5,692 | ||||||||||||||||||||||||
| 38 | 14,70 | 0,0880 | 362,1 | 1472,6 | 362,1 | 5,674 | ||||||||||||||||||||||||||||
| 40 | 15,54 | 0,0833 | 371,9 | 1473,3 | 1,360 | 4,877 | 1622.4 | 5,321 | 1751,9 | 5,655 | ||||||||||||||||||||||||
| 42 | 16,42 | 0,0788 | 381,8 | 1473,8 | 1,391 | 4,856 16292 | 4,856 | 4,856 | 17,34 | 0,0746 | 391,8 | 1474,2 | 1,422 | 4,835 | 1626,8 | 5,284 | 1758.0 | 5,619 | ||||||||||||||||
| 46 | 18,30 | 0,0706 | 401,8 | 1474,5 | 1,453 | 4,814 | 1629,0 | 5,266 | 5,266 | 411,9 | 1474,7 | 1,484 | 4,793 | 1631,1 | 5,248 | 1764,0 | 5,584 | |||||||||||||||||
| 50 | 20.33 | 0,0635 | 421,9 | 1474,7 | 1,515 | 4,773 | 1633,1 | 5,230 | 1766,8 | 5,567 | ||||||||||||||||||||||||

