Трансмиссивная саркома › Белый Клык
Трансмиссивная саркома — уникальная патология, характерная только для собак. Это злокачественная опухоль, развивающаяся на слизистой оболочке половых органов и передающаяся от собаки к собаке половым путем. Трансмиссивная саркома — чрезвычайно распространенное заболевание.
Причины
Трансмиссивная саркома не может возникнуть «сама по себе» — заражение собаки происходит при ПОЛОВОМ контакте (отсюда и второе название «венерическая саркома») с уже больным животным. Опухоль передается чисто механически: кусочек (может даже микроскопический) прилипает к слизистой оболочке половых органов здоровой собаки и вырастает затем в полноценную опухоль.
Важнейшую роль в распространении трансмиссивной саркомы играют роль бездомные собаки. Они являются природным резервуаром этой патологии, заражая «хозяйских» собак, убегающих иногда в поисках любви.
Признаки заболевания
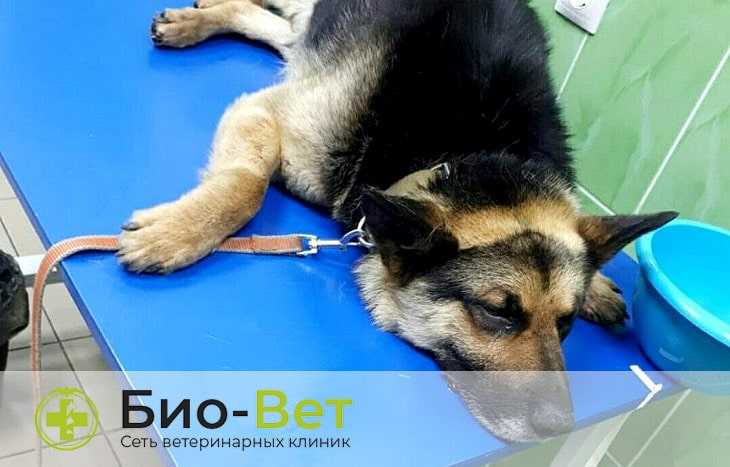
Основной признак, позволяющий заподозрить наличие трансмиссивной саркомы у собаки — выделение капель крови из половых органов. Владельцы сук часто принимают это за начинающуюся или продолжающуюся течку. У кобелей необходимо дифференцировать кровянистые истечения при трансмиссивной саркоме от проявления простатита (см. нашу статью). У сук нужно исключить пиометру (также см. статью). При трансмиссивной саркоме кровянистые истечения обычно имеют постоянный характер. Иногда можно видеть и саму опухоль: ярко-красного цвета с бугристой кровавой поверхностью.
Владельцы сук часто принимают это за начинающуюся или продолжающуюся течку. У кобелей необходимо дифференцировать кровянистые истечения при трансмиссивной саркоме от проявления простатита (см. нашу статью). У сук нужно исключить пиометру (также см. статью). При трансмиссивной саркоме кровянистые истечения обычно имеют постоянный характер. Иногда можно видеть и саму опухоль: ярко-красного цвета с бугристой кровавой поверхностью.
Признаки трансмиссивной венерической саркомы собак
Первый клинический признак опухоли — выделение капель крови из наружных половых органов, при осмотре которых обнаруживается рыхлое кровоточащее образование на широком основании, напоминающее цветную капусту.
Лечение
Возможно консервативное и оперативное лечение при трансмиссивной саркоме. Для консервативного лечения применяют комбинацию противоопухолевых препаратов (химиотерапию). Существенным недостатком химиотерапии является высокая токсичность препаратов (возможен даже летальный исход).![]() Поэтому область применения консервативного лечения при трансмиссивной саркоме ограничена неоперабельными случаями.
Поэтому область применения консервативного лечения при трансмиссивной саркоме ограничена неоперабельными случаями.
Оперативное лечение заключается в ПОЛНОМ удалении ВСЕХ опухолей в пределах здоровой ткани. Если на слизистой оболочке оставить даже минимальное количество опухолевых клеток, возможен рецидив (повторный рост опухоли).
Принципиально операция несложная, однако от хирурга может потребоваться достаточно высокая техника оперирования, поскольку серьезное кровотечение способно осложнить состояние пациента. Также необходимо крайне деликатное обращение с устьем мочеиспускательного канала — при грубом подходе возможна его послеоперационная закупорка.
В исключительных случаях, когда опухолевым процессом бывает поражена большая часть влагалища, мы предпринимаем тотальное удаление влагалища с ТРАНСПОЗИЦИЕЙ (переносом) мочеиспускательного канала на брюшную стенку. При этом собака сохраняет способность ПОЛНОСТЬЮ КОНТРОЛИРОВАТЬ| процесс мочеиспускания и живет полноценной жизнью. ВСЕ подобные операции, проведенные в нашей клинике, закончились благоприятно (сроки наблюдения от 9 мес. до 7 лет!)
ВСЕ подобные операции, проведенные в нашей клинике, закончились благоприятно (сроки наблюдения от 9 мес. до 7 лет!)
Лікарь ветеринарної медицини Ваховський О.П.
Венерическая саркома у собак — симптомы, лечение, диагностика
Ветклиника ВетОстров > Услуги > Онкология и химиотерапия > Венерическая саркома у собак
Данное заболевание известно более сотни лет и после 1906 года называлось саркомой Штикера.
Опухоли у собак делятся на 3 вида:
- доброкачественные,
- злокачественные,
- трансмиссивная венерическая саркома.
Последнее заболевание является уникальным, т.к. оно является заразным в семействе псовых. Но источником инфеции является не вирус, не бактерия, а опухолевая клетка.
Венерическая саркома передается преимущественно при половых контактах и чаще всего поражает слизистые оболочки половых органов и ротовой полости, ибо через вылизывание собаки осуществляют гигиену своих половых органов.
В более редких и запущенных случаях возможно поражение других участков кожи.
Преимущества лечения венерической саркомы у собак в ВЕТОСТРОВЕ
- Врачи наших ветеринарных клиник имеют позитивный опыт диагностики и лечения этого заболевания.
- Наши хирурги готовы вести удаление таких видов опухолей.
- Опытные доктора проведут курс химиотерапии вашей собаке и доведут животное до полного выздоровления!
Симптомы заболевания
Кто подвержен трансмиссивной венерической саркоме?
- Собаки, гуляющие без поводка.
- Животные, убегающие в периоды половой охоты и ведущие бесконтрольные половые сношения.
- Племенные собаки с частыми вязками со всеми желающими без контроля и соблюдения гигиены .
Признаками появления этого вида опухолей чаще всего являются:
- кровянистые выделения из половых органов
- объемные образования на половом члене, в препуции у кобелей
- образования, находящиеся во влагалище у самок,
- разросты у обоих полов во рту.

- нарушение мочеиспускания, уменьшение струи мочи
- увеличение половых органов и выпячивание под кожей
- опухоль имеет неровные края, напоминая соцветия цветной капусты.
Диагностика болезни
Диагноз ставится окончательно только гистологически, т.к. есть опухоли, дающие похожую картину. Хотя анамнез и осмотр опухоли уже составляют более половины информации для правильной постановки диагноза. Забор биопсии с измененных тканей не представляет обычно проблемы и не требует седации пациента.
Лечение заболевания
Существует два метода лечения венерической саркомы:
- хирургическое иссечение пораженного участка — удаление опухоли,
- химиотерапия.
Оба метода позволяют эффективно справится с данным заболеванием, но если опухоль затронула обширные участки, химиотерапия будет предпочтительнее.
Длительность лечения зависит от стадии развития болезни, и чем раньше владелец обратится в ветеринарную клинику, тем быстрее будет выздоровление питомца.
Автор статьи Олейник А.А., ветеринарный врач-терапевт
Трансмиссивная венерическая опухоль | VCA Animal Hospital
Что такое трансмиссивные венерические опухоли (TVT)?
Трансмиссивные венерические опухоли (TVT) — это опухоли, возникающие в результате нерегулируемого роста клеток, называемых гистиоцитами. Гистоциты — это тип клеток иммунной системы, обнаруженный во многих частях тела, включая кожу. TVT развиваются из кожных гистиоцитов.
ТВЦ – злокачественные (раковые) опухоли. В отличие от других видов рака, TVT могут передаваться между собаками. Он передается половым путем при прямом кожном контакте с опухолью, что приводит к пересадке раковых клеток от собаки к собаке. Этот тип опухоли чаще встречается в тропических и субтропических районах, особенно в Центральной/Южной Америке, на юге США, в Азии и Африке, хотя встречается во всем мире. Восприимчивы собаки любой породы, возраста или пола, но чаще всего это наблюдается у собак смешанных пород, собак, которые не имеют половых контактов (не стерилизованы или стерилизованы), а также бездомных и свободно гуляющих собак.
Что вызывает этот рак?
Предполагается, что этот тип рака развился тысячи лет назад у волков и диких собак в результате мутации основного генетического материала гистиоцитов. Считается, что дополнительные генетические мутации в этих клетках необходимы для того, чтобы они стали злокачественными (раковыми).
Наиболее распространенной причиной этого рака является непосредственный контакт с собакой с TVT, который включает половой контакт (сношение), облизывание, укусы и обнюхивание пораженных опухолью участков.
Каковы признаки того, что у моей собаки этот тип опухоли?
Признаки этого типа опухоли у вашей собаки полностью зависят от локализации опухоли. При локализации на половом члене/крайней плоти или вульве может наблюдаться неравномерное утолщение ткани, дискомфорт, периодические кровотечения или кровоподтеки.
«Признаки этого типа опухоли у вашей собаки полностью зависят от локализации опухоли».
Вы можете заметить, что ваша собака чрезмерно облизывает это место. Если они расположены во рту или на языке, вы можете наблюдать узелки, похожие на цветную капусту, которые растут и продолжают расти в этих областях. Они могут изъязвляться и кровоточить.
Если они расположены во рту или на языке, вы можете наблюдать узелки, похожие на цветную капусту, которые растут и продолжают расти в этих областях. Они могут изъязвляться и кровоточить.
Как диагностируется этот тип опухоли?
Этот тип опухоли обычно диагностируется с помощью цитологии. Цитология – это микроскопическое исследование образцов клеток. Образцы клеток могут быть собраны либо путем мазка области ватным тампоном, либо с помощью тонкоигольной аспирации (FNA). FNA включает взятие маленькой иглы со шприцем и отсасывание образца клеток непосредственно из опухоли.
После сбора клетки помещаются на предметное стекло микроскопа. Затем ветеринарный патологоанатом исследует предметное стекло под микроскопом. В некоторых случаях результаты цитологии могут быть не совсем четкими, и может потребоваться биопсия. Биопсия – это хирургическое иссечение кусочка опухоли. Затем кусочек (или кусочки) опухоли исследует ветеринарный патологоанатом под микроскопом. Это называется гистопатологией.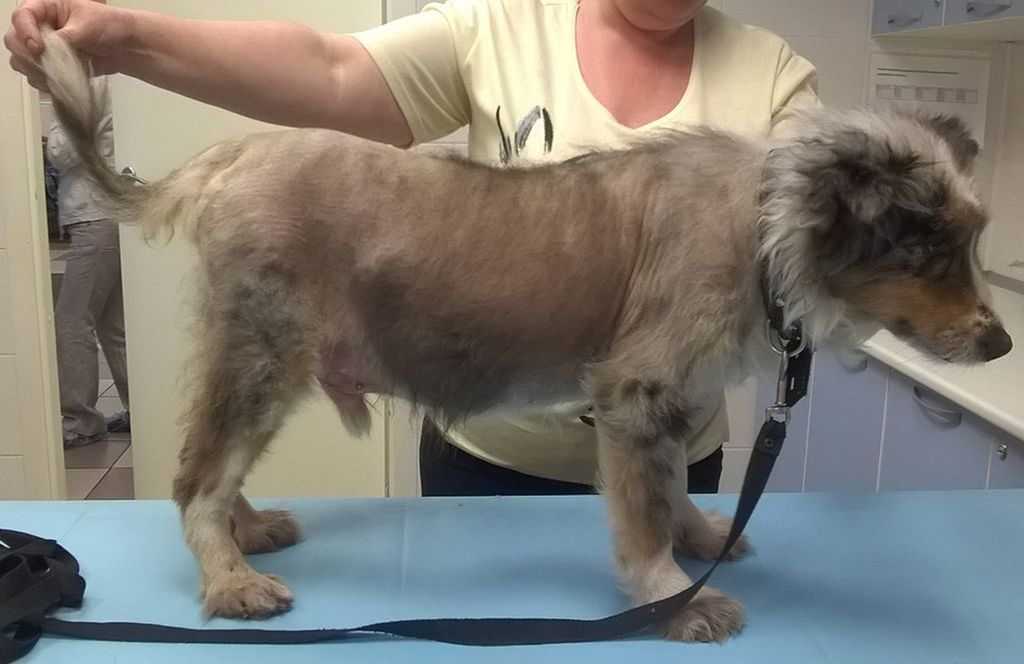
Как обычно развивается этот рак?
В большинстве случаев этот рак обычно остается локальным, что означает, что он поражает только ту область, которая первоначально соприкасалась с раком. Хотя этот рак может исчезнуть сам по себе (спонтанная регрессия) из-за реакции иммунной системы, это случается крайне редко. TVT обычно продолжают расти и могут становиться все более неприятными без лечения. В редких случаях ТВТ могут метастазировать (распространяться на другие участки тела), обычно в близлежащие лимфатические узлы.
Какие существуют методы лечения этого типа опухоли?
Полное хирургическое иссечение, лучевая терапия и химиотерапия являются эффективными методами лечения; однако химиотерапия считается методом выбора. Полное хирургическое иссечение может быть затруднено (и часто невыполнимо) из-за расположения этих опухолей. Само хирургическое вмешательство часто приводит к рецидиву. При наличии резистентности к химиотерапии может потребоваться лучевая терапия.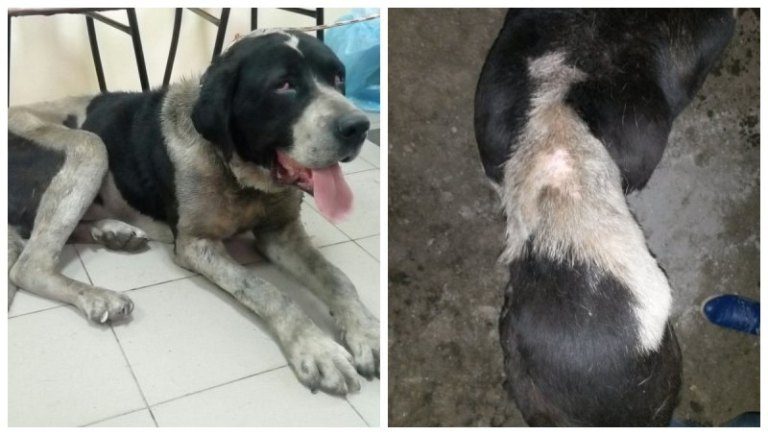 Прогноз для полной ремиссии при химиотерапии или лучевой терапии благоприятный.
Прогноз для полной ремиссии при химиотерапии или лучевой терапии благоприятный.
Есть что-нибудь еще, что я должен знать?
Если у вашей собаки был диагностирован TVT, наиболее вероятно, что он заразился от другой собаки. До тех пор, пока ваша собака не будет пролечена и ваш ветеринар не определит, что лечение успешно устранило опухоль, следует избегать контакта с другими собаками. Эти опухоли могут стать беспокоящими, изъязвляться и кровоточить. Если у вашего питомца развился TVT, лечение следует начать как можно скорее, чтобы избежать передачи болезни другим собакам и риска (хотя и редкого) метастазирования.
ГЕНОМ ТРАНСМИССИРУЕМОГО РАКА СОБАКИ РАСКРЫВАЕТ ПРОИСХОЖДЕНИЕ И ИСТОРИЮ ДРЕВНЕЙ КЛЕТОЧНОЙ ЛИНИИ
- Список журналов
- Рукописи авторов ЧВК Европы
- PMC3918581
Наука. Авторская рукопись; доступно в PMC 2014 24 июля.
Авторская рукопись; доступно в PMC 2014 24 июля.
Опубликовано в окончательной редакции как:
Наука. 2014 24 января; 343 (6169): 437–440.
doi: 10.1126/science.1247167
PMCID: PMC3918581
EMSID: EMS56406
PMID: 24458646
, # 1, 2, * , # 1 , 1 , 1 , 1 , 1 , 1 , 1 , 3 , 4 0 , 3906 5 , 6 , 1 , 1 , 7 , 6 и 1, *
Информация о материалах и лицензии. венерическая опухоль (CTVT) является старейшей из известных линий соматических клеток. Это трансмиссивный рак, который естественным образом распространяется у собак. Мы секвенировали геномы двух опухолей CTVT и обнаружили, что CTVT приобрел 1,9миллионов соматических мутаций замещения и имеет признаки воздействия ультрафиолетового света. CTVT удивительно стабилен и не имеет субклональной гетерогенности, несмотря на тысячи реаранжировок, изменения числа копий и вставки ретротранспозонов. Более 10 000 генов несут несинонимичные варианты, а 646 генов были утеряны. CTVT впервые возник у собаки с низкой геномной гетерозиготностью, которая, возможно, жила примерно 11 000 лет назад. Рак, порожденный этим человеком, распространился по континентам примерно 500 лет назад. Наши результаты представляют собой генетический фоторобот древней собаки и демонстрируют устойчивость соматических клеток млекопитающих к выживанию в течение тысячелетий, несмотря на огромное количество мутаций.
CTVT удивительно стабилен и не имеет субклональной гетерогенности, несмотря на тысячи реаранжировок, изменения числа копий и вставки ретротранспозонов. Более 10 000 генов несут несинонимичные варианты, а 646 генов были утеряны. CTVT впервые возник у собаки с низкой геномной гетерозиготностью, которая, возможно, жила примерно 11 000 лет назад. Рак, порожденный этим человеком, распространился по континентам примерно 500 лет назад. Наши результаты представляют собой генетический фоторобот древней собаки и демонстрируют устойчивость соматических клеток млекопитающих к выживанию в течение тысячелетий, несмотря на огромное количество мутаций.
Трансмиссивная венерическая опухоль собак (CTVT) является естественным трансмиссивным раком. Это клональная клеточная линия, которая распространяется в популяции домашних собак путем аллогенного переноса живых раковых клеток, обычно во время полового акта. Заболевание проявляется появлением опухолей, чаще всего связанных с наружными половыми органами у самцов и самок собак. Первое известное сообщение о CTVT было сделано в 1810 году, когда лондонский ветеринарный врач описал его как «язвенное состояние, сопровождающееся грибковым разрастанием», которое возникает в «органах, участвующих в порождении» (1). Впоследствии о нем сообщалось в популяциях собак по всему миру (2, 3), и, насколько нам известно, это самый старый и наиболее широко распространенный рак в мире природы.
Первое известное сообщение о CTVT было сделано в 1810 году, когда лондонский ветеринарный врач описал его как «язвенное состояние, сопровождающееся грибковым разрастанием», которое возникает в «органах, участвующих в порождении» (1). Впоследствии о нем сообщалось в популяциях собак по всему миру (2, 3), и, насколько нам известно, это самый старый и наиболее широко распространенный рак в мире природы.
Мы секвенировали геномы двух опухолей CTVT, собранных в Манингриде, Австралия (24T), и Франке, Бразилия (79T), а также геномы их соответствующих хозяев 24H, аборигенной походной собаки, и 79H, американского кокер-спаниеля. (). Мы также подготовили метафазы для цитогенетического анализа из двух CTVT, собранных в Кабо-Верде и Италии. Метафазная флуоресцентная гибридизация in situ (FISH) с использованием хромосом рыжей лисицы в качестве зондов выявила массивную кариотипическую перестройку в геноме CTVT, которая в высокой степени соответствовала между двумя проанализированными опухолями ().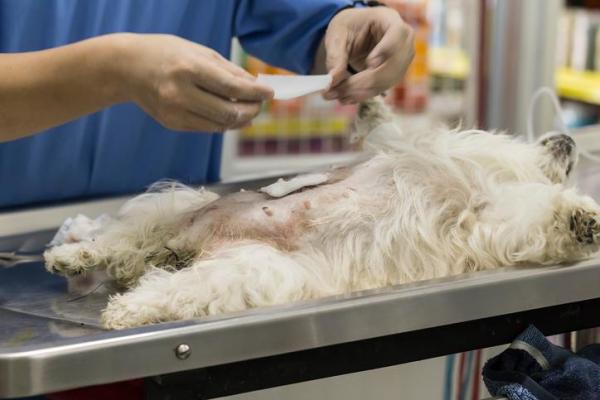 Несмотря на анеуплоидию при CTVT, обнаруженную с помощью цитогенетики, анализ количества копий показал, что геном в значительной степени диплоидный (включая большую часть генома, который является диплоидным с потерей гетерозиготности (LOH)) и что было минимальное изменение статуса количества копий у либо 24Т либо 79Линии T с момента их расхождения (, таблицы S1 и S2). В отличие от опухолей человека, большинство из которых содержат несколько поддающихся обнаружению субклонов (4), предположительно из-за положительного отбора в отношении вновь приобретенных мутаций, дающих селективное преимущество (5), мы не обнаружили доказательств субклональности в метафазах CTVT или графиках числа копий. Это говорит о том, что CTVT не подвергается положительному отбору с высокой частотой, что, возможно, указывает на то, что он хорошо адаптирован к своей нише.
Несмотря на анеуплоидию при CTVT, обнаруженную с помощью цитогенетики, анализ количества копий показал, что геном в значительной степени диплоидный (включая большую часть генома, который является диплоидным с потерей гетерозиготности (LOH)) и что было минимальное изменение статуса количества копий у либо 24Т либо 79Линии T с момента их расхождения (, таблицы S1 и S2). В отличие от опухолей человека, большинство из которых содержат несколько поддающихся обнаружению субклонов (4), предположительно из-за положительного отбора в отношении вновь приобретенных мутаций, дающих селективное преимущество (5), мы не обнаружили доказательств субклональности в метафазах CTVT или графиках числа копий. Это говорит о том, что CTVT не подвергается положительному отбору с высокой частотой, что, возможно, указывает на то, что он хорошо адаптирован к своей нише.
Открыть в отдельном окне
Опухоли CTVT, кариотипы и номер копии
(A) Образцы, секвенированные в этом исследовании.
(B) Мультиплексная FISH с использованием зондов Red Fox для исследования кариотипов нормальной суки (слева) и CTVT, собранных в Кабо-Верде (в центре) и Италии (справа).
(C) Номер геномной копии CTVT для 24T (верхняя панель) и 79T (нижняя панель). Красные и синие точки представляют собой общее количество копий и количество второстепенных копий (т. е. количество копий аллеля, присутствующего в меньшем количестве копий), рассчитанные соответственно с использованием нормализованного количества прочтений в каждом из 2 544 508 локусов SNP. Хромосомы представлены горизонтальными чередующимися черными и серыми полосами.
Массивное бремя кариотипических аномалий CTVT, несмотря на его в основном диплоидное число копий генома, указывает на то, что геном подвергся крупномасштабной копийно-нейтральной структурной перестройке. Мы обнаружили 2118 кандидатов соматических структурных вариантов, которые были общими для 24T и 79T, и 216 и 72 кандидата соматических структурных вариантов в 24T и 79T соответственно, которые были уникальными для одной опухоли.
Мы идентифицировали 3,04 миллиона вариантов замены в 24T и 2,77 миллиона в 79T после удаления всех однонуклеотидных полиморфизмов (SNP), о которых известно, что они выделяются в зародышевой линии собак или волков (включая те, которые идентифицированы в 24H или 79H). Эти варианты будут включать соматические мутации, а также SNP, которые не были обнаружены в предыдущих усилиях по секвенированию собак. Мы оценили истинное количество соматических мутаций замещения в CTVT, рассчитав соотношение гомозиготных и гетерозиготных известных SNP в диплоидных областях, которые сохраняют обе родительские хромосомы. Предполагая, что все гомозиготные варианты в этих регионах являются SNP, мы смогли оценить количество неаннотированных гетерозиготных SNP в каждом диплоидном сегменте, используя соотношение гомозиготных и гетерозиготных среди аннотированных SNP. Этот анализ показал, что по крайней мере 65% неаннотированных вариантов CTVT, вероятно, являются соматическими, что соответствует в общей сложности ~ 1,9миллионов соматических мутаций в CTVT. 103 667 и 109 119 вариантов были уникальными для 24T и 79T соответственно, большинство из которых, вероятно, возникли как соматические мутации после расхождения двух опухолей, поскольку только 2056 и 5647 из них соответственно встречаются в областях, которые были потеряны в другой опухоли. Хотя при раке человека наблюдается диапазон общего количества мутаций, большинство из них имеют от 1000 до 5000 соматических мутаций с заменой одного основания (6). Таким образом, CTVT приобрел в несколько сотен раз больше соматических мутаций, чем большинство раковых заболеваний человека.
Этот анализ показал, что по крайней мере 65% неаннотированных вариантов CTVT, вероятно, являются соматическими, что соответствует в общей сложности ~ 1,9миллионов соматических мутаций в CTVT. 103 667 и 109 119 вариантов были уникальными для 24T и 79T соответственно, большинство из которых, вероятно, возникли как соматические мутации после расхождения двух опухолей, поскольку только 2056 и 5647 из них соответственно встречаются в областях, которые были потеряны в другой опухоли. Хотя при раке человека наблюдается диапазон общего количества мутаций, большинство из них имеют от 1000 до 5000 соматических мутаций с заменой одного основания (6). Таким образом, CTVT приобрел в несколько сотен раз больше соматических мутаций, чем большинство раковых заболеваний человека.
Чтобы установить процессы, ответственные за мутации в CTVT, мы охарактеризовали спектр мутаций CTVT и провели поиск известных мутационных сигнатур (6) в геномах CTVT. В спектре мутаций CTVT преобладали мутации C>T (или G>A) и динуклеотидные мутации CC>TT (или GG>AA) (). В CTVT были идентифицированы четыре мутационных сигнатуры (обозначенные от A до D, ), которых было достаточно, чтобы объяснить 98% мутаций в CTVT (корреляция Пирсона 0,96 между набором мутаций, наблюдаемым в CTVT, и набором мутаций, реконструированным с использованием четырех мутационных сигнатур). Химические события, связанные с некоторыми из этих мутационных сигнатур, были охарактеризованы. Сигнатура А связана с SNP зародышевой линии, и ее вклад в наборы вариантов CTVT, вероятно, отражает неполное удаление вариантов, унаследованных зародышевой линией. Сигнатура B определяет мутационную сигнатуру, характеризующуюся C>T в динуклеотидах CpG, которая широко встречается при раке человека и, как известно, коррелирует с возрастом пациента (6). Сигнатура C (известная как сигнатура 5 в (6)) также часто присутствует в ряде раковых заболеваний человека, однако ее этиология неизвестна (6). Сигнатура D, которая характеризуется мутациями C>T и CC>TT и у людей преимущественно наблюдается при раке кожи и, как известно, связана с воздействием ультрафиолетового света (6), объясняет 42% мутаций CTVT.
В CTVT были идентифицированы четыре мутационных сигнатуры (обозначенные от A до D, ), которых было достаточно, чтобы объяснить 98% мутаций в CTVT (корреляция Пирсона 0,96 между набором мутаций, наблюдаемым в CTVT, и набором мутаций, реконструированным с использованием четырех мутационных сигнатур). Химические события, связанные с некоторыми из этих мутационных сигнатур, были охарактеризованы. Сигнатура А связана с SNP зародышевой линии, и ее вклад в наборы вариантов CTVT, вероятно, отражает неполное удаление вариантов, унаследованных зародышевой линией. Сигнатура B определяет мутационную сигнатуру, характеризующуюся C>T в динуклеотидах CpG, которая широко встречается при раке человека и, как известно, коррелирует с возрастом пациента (6). Сигнатура C (известная как сигнатура 5 в (6)) также часто присутствует в ряде раковых заболеваний человека, однако ее этиология неизвестна (6). Сигнатура D, которая характеризуется мутациями C>T и CC>TT и у людей преимущественно наблюдается при раке кожи и, как известно, связана с воздействием ультрафиолетового света (6), объясняет 42% мутаций CTVT. . Эти наблюдения предполагают, что CTVT подвергался низкому уровню ультрафиолетового излучения во время своей эволюции. Хотя опухоли CTVT обычно возникают внутри генитального отверстия, они могут подвергаться воздействию солнечного света, когда выпячиваются из вульвы, изъязвляются через кожу препуция или появляются на внешних поверхностях, таких как кожа или конъюнктива (например, см. 24T и 79).Т, ). Более того, именно те клетки, которые выставлены на поверхность опухоли, с наибольшей вероятностью будут распространять линию CTVT путем перехода к новым хозяевам.
. Эти наблюдения предполагают, что CTVT подвергался низкому уровню ультрафиолетового излучения во время своей эволюции. Хотя опухоли CTVT обычно возникают внутри генитального отверстия, они могут подвергаться воздействию солнечного света, когда выпячиваются из вульвы, изъязвляются через кожу препуция или появляются на внешних поверхностях, таких как кожа или конъюнктива (например, см. 24T и 79).Т, ). Более того, именно те клетки, которые выставлены на поверхность опухоли, с наибольшей вероятностью будут распространять линию CTVT путем перехода к новым хозяевам.
Открыть в отдельном окне
Мутации CTVT
Анализы были выполнены на наборе из 395 306 вариантов CTVT, которые были аннотированы как соматические из-за их гетерозиготного статуса в геномных областях, которые претерпели как потерю гетерозиготности (LOH), так и дупликацию .
(A) Спектр простых мутаций в CTVT. Мутации помечены в пиримидиновом контексте.
(B) Спектр динуклеотидных мутаций в CTVT. «Первое основание» было определено как мутация с более низкой координатой хромосомы, а «второе основание» непосредственно примыкает к первому основанию на той же цепи. Цепь отображается относительно пиримидинового контекста первого основания. В анализ было включено 3518 динуклеотидных мутаций.
(C) Доля мутаций в CTVT, объясняемая мутационными сигнатурами от A до D.
Более 10 000 генов (10,955 в 24T и 10 546 в 79T) в CTVT несут по крайней мере один вариант несинонимичной замены, который не является известным SNP зародышевой линии. В таблице S3 перечислены те гены, которые мы считаем драйверными мутациями с наивысшей степенью достоверности при CTVT. К ним относятся известная реаранжировка с участием MYC (7), гомозиготная делеция CDKN2A , гемизиготная нонсенс-мутация в SETD2 и реаранжировка с участием ERG , которая создает потенциальный слитый ген NEK1-ERG в рамке считывания. Перепись генов, которые были потеряны при CTVT в результате гомозиготной делеции или гемизиготной нонсенс-мутации, показала, что по крайней мере 646 генов, 2,8% из 22 874 генов, кодирующих белок, аннотированных в геноме собаки, в совокупности необходимы для выживания и пролиферации соматической клетки. (Таблица S4).
Перепись генов, которые были потеряны при CTVT в результате гомозиготной делеции или гемизиготной нонсенс-мутации, показала, что по крайней мере 646 генов, 2,8% из 22 874 генов, кодирующих белок, аннотированных в геноме собаки, в совокупности необходимы для выживания и пролиферации соматической клетки. (Таблица S4).
Затем мы попытались реконструировать фенотип животного-основателя CTVT и оценить возраст рака, который он породил, используя варианты, обнаруженные в геноме CTVT. Мы сравнили генотипы 24T и 79T, а также 24H и 79H по 23 782 полиморфным локусам SNP с генотипами 1106 ранее генотипированных собак, волков и койотов (8, 9). Результат, отображаемый с использованием анализа основных компонентов (), указывает на то, что животное-основатель CTVT, вероятно, было собакой, принадлежащей к одной из «Древних пород» (предыдущие анализы не могли отличить волка от собаки «Древней породы»). происхождение (10)). Анализ дерева попарных расстояний показал, что из 86 включенных в анализ пород (9), животные-основатели CTVT наиболее тесно связаны с аляскинскими маламутами и хаски (11 аляскинских маламутов имеют > 95% вероятность после повторной выборки генотипов иметь один из 16 генотипов, наиболее близких к CTVT) (и Таблица S5). Как и ожидалось, 79H наиболее тесно сгруппировался с кокер-спаниелями среди современных пород (вероятность> 95% после повторной выборки, что каждый из шести ближайших генотипов является английским кокер-спаниелем) (и Таблица S5). 24H, лагерная собака аборигенов, имеет генетический вклад как от древних, так и от современных пород (и Таблица S5).
Как и ожидалось, 79H наиболее тесно сгруппировался с кокер-спаниелями среди современных пород (вероятность> 95% после повторной выборки, что каждый из шести ближайших генотипов является английским кокер-спаниелем) (и Таблица S5). 24H, лагерная собака аборигенов, имеет генетический вклад как от древних, так и от современных пород (и Таблица S5).
Открыть в отдельном окне
Отслеживание животного-основателя CTVT
(A) Анализ главных компонентов 1106 волков, собак и койотов с использованием генотипов по 23782 полиморфным локусам SNP (8, 9). Каждая особь представлена одной цветной точкой и указаны положения CTVT (выведенные из генотипов 24T и 79T), 24H и 79H. Породы были классифицированы как современные или древние в соответствии с (27).
(B) Позиции CTVT (слева), 24H (в центре) и 79H (справа) на дереве попарных расстояний, сравнивающем генотипы по 23 782 локусам SNP с 1106 другими собаками, волками и койотами (8, 9). Показаны только породы, наиболее близкие к CTVT, 24H и 79H. Породы, содержащие членов, которые наиболее сильно группировались с CTVT и 79H после повторной выборки генотипа, отмечены красным текстом и * (см. Таблицу S5, 24H не группировался сильно с особями какой-либо одной породы). NGSD, поющая собака Новой Гвинеи.
Показаны только породы, наиболее близкие к CTVT, 24H и 79H. Породы, содержащие членов, которые наиболее сильно группировались с CTVT и 79H после повторной выборки генотипа, отмечены красным текстом и * (см. Таблицу S5, 24H не группировался сильно с особями какой-либо одной породы). NGSD, поющая собака Новой Гвинеи.
(C) Число копий половой хромосомы 24H (самка собаки), 79H (собака), 24T и 79T, определяемые путем подсчета количества прочтений, совпадающих с X- и Y-хромосомами, и нормализованных до 79H. Прочтения Y-хромосомы в 79T, вероятно, происходят из-за загрязнения ДНК хозяина.
(D) Доля аннотированных локусов SNP в диплоидных областях зародышевой линии, гетерозиготных по 24H, 79H, 24T и 79T.
(E) Хронология возникновения и расхождения CTVT.
Недавние исследования выявили несколько локусов, определяющих фенотипические признаки собак, такие как цвет шерсти, морфология и поведение (11-21). Мы исследовали последовательность CTVT в ряде этих локусов, чтобы определить вероятный фенотип животного-основателя (таблица S6). Наш анализ показал, что животное-основатель, вероятно, было среднего или крупного размера с агути или сплошной черной шерстью. Он нес смесь «волчьих» и «собачьих» аллелей в локусах, которые были связаны с одомашниванием собак (21). 24Т и 79Каждый T нес одну Х-хромосому и не имел признаков Y-хромосомы, как было обнаружено в предыдущем анализе (22). Это согласуется либо с мужчиной (после соматической потери Y-хромосомы), либо с женщиной (после соматической потери X-хромосомы) Животным-основателем (). Анализ полногеномной гетерозиготности показал, что Животное-Основатель было относительно инбредным ().
Наш анализ показал, что животное-основатель, вероятно, было среднего или крупного размера с агути или сплошной черной шерстью. Он нес смесь «волчьих» и «собачьих» аллелей в локусах, которые были связаны с одомашниванием собак (21). 24Т и 79Каждый T нес одну Х-хромосому и не имел признаков Y-хромосомы, как было обнаружено в предыдущем анализе (22). Это согласуется либо с мужчиной (после соматической потери Y-хромосомы), либо с женщиной (после соматической потери X-хромосомы) Животным-основателем (). Анализ полногеномной гетерозиготности показал, что Животное-Основатель было относительно инбредным ().
Предыдущие исследования показали, что возраст CTVT составляет от 200 до 70 000 лет (10, 23). Мы стремились уточнить возраст CTVT, используя мутации, связанные с мутационной сигнатурой B (), которая коррелирует с возрастом пациента при постановке диагноза при многих типах рака (6, 24). Мы подсчитали, что 492533 мутации в CTVT, вероятно, были вызваны этим мутационным процессом. Используя частоту мутаций сигнатуры B в медуллобластоме человека в качестве молекулярных часов (43,3 мутации этой сигнатуры по всему геному в год; мы выбрали медуллобластому, потому что это рак человека с наиболее тесной корреляцией между количеством мутаций этой сигнатуры и возрастом пациента ( 6)), по нашим оценкам, CTVT впервые мог возникнуть приблизительно 11 368 лет назад (нижний и верхний доверительные интервалы 10 179 и 12 873 года соответственно).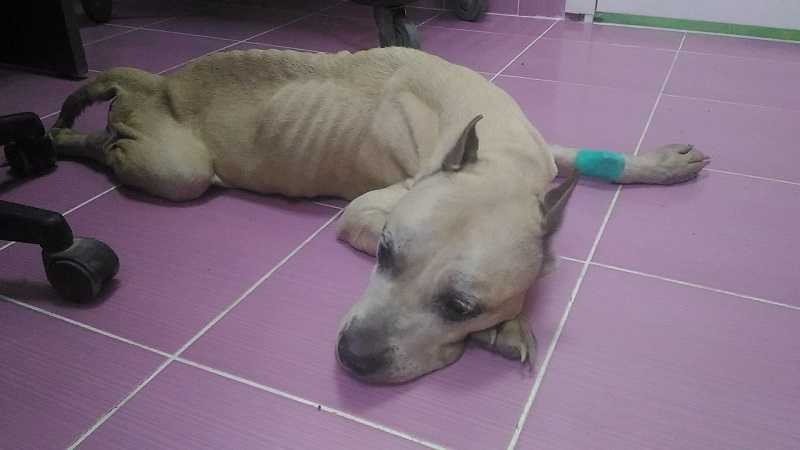 В этой оценке есть неопределенность, вызванная возможностью того, что накопление мутаций этой сигнатуры не является часовым при CTVT или что существуют ткане- или видовые различия в скорости накопления мутаций между CTVT и медуллобластомой человека. Применяя эти молекулярные часы к мутациям, которые произошли после расхождения двух опухолей, мы предполагаем, что самый недавний общий предок 24T и 79Т мог существовать примерно 460 лет назад (458,2 года для 24Т, 459,8 года для 79Т) (). Интересно, что предполагаемое время этого расхождения совпадает с эпохой быстрого глобального исследования человеком.
В этой оценке есть неопределенность, вызванная возможностью того, что накопление мутаций этой сигнатуры не является часовым при CTVT или что существуют ткане- или видовые различия в скорости накопления мутаций между CTVT и медуллобластомой человека. Применяя эти молекулярные часы к мутациям, которые произошли после расхождения двух опухолей, мы предполагаем, что самый недавний общий предок 24T и 79Т мог существовать примерно 460 лет назад (458,2 года для 24Т, 459,8 года для 79Т) (). Интересно, что предполагаемое время этого расхождения совпадает с эпохой быстрого глобального исследования человеком.
Животное-основатель, чьи соматические клетки впервые дали начало CTVT, была собакой «Древней породы», которая, возможно, жила около 11 000 лет назад. Дата появления CTVT вместе со структурой его филогенетического древа (23) и доказательствами наличия как волкоподобных, так и собачьих аллелей в локусах, связанных с одомашниванием, согласуются с возможностью того, что CTVT мог впервые возникнуть в генетически изолированной популяции ранние собаки, чье ограниченное генетическое разнообразие способствовало ускользанию рака от иммунной системы его хозяев.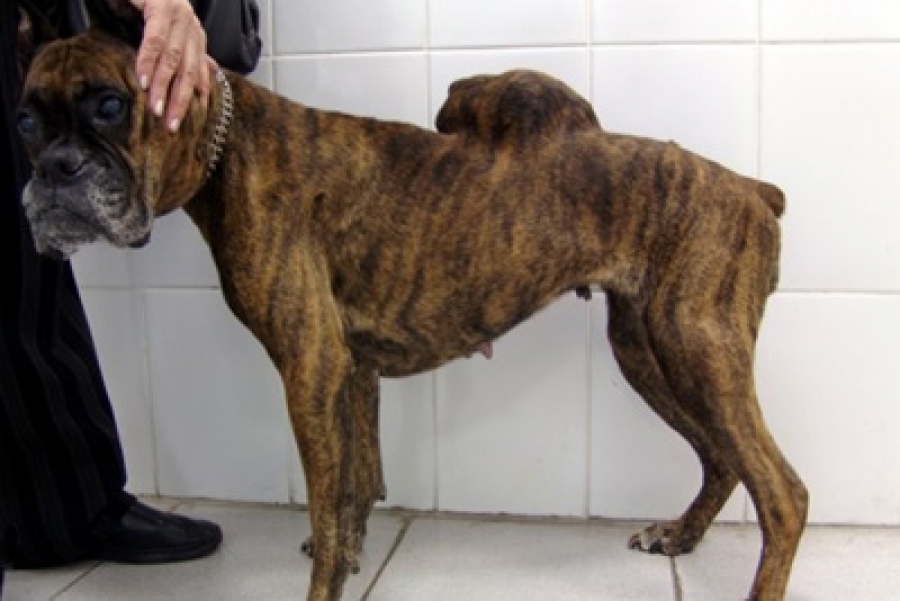 Точно так же лицевая опухоль тасманийского дьявола, единственный известный природный клонально-трансмиссивный рак, возникла у островной популяции с низким генетическим разнообразием (25, 26). Популяции с ограниченным генетическим разнообразием могут быть особенно восприимчивы к возникновению и распространению трансмиссивных раковых заболеваний.
Точно так же лицевая опухоль тасманийского дьявола, единственный известный природный клонально-трансмиссивный рак, возникла у островной популяции с низким генетическим разнообразием (25, 26). Популяции с ограниченным генетическим разнообразием могут быть особенно восприимчивы к возникновению и распространению трансмиссивных раковых заболеваний.
Геном CTVT пролил свет на происхождение, историю и эволюцию древнейшего из известных видов рака в мире. Примечательно, что соматический геном, ДНК которого в норме сохранялся бы не более 15 лет при жизни одной собаки, продолжал существовать в течение нескольких тысячелетий как паразитическая форма жизни. Выживание и глобальное доминирование CTVT является свидетельством способности генома соматических клеток млекопитающих адаптироваться и сохраняться в новой экологической нише.
Дополнительные данные 1
Нажмите здесь для просмотра. (603K, документ)
Таблица 4
Щелкните здесь для просмотра. (34K, xlsx)
(34K, xlsx)
Эта работа была поддержана Wellcome Trust (номер гранта 098051), благотворительным фондом Kadoorie и стипендией L’Oreal-UNESCO For Women in Science Fellowship (EPM). Мы благодарны Эндрю Кингу, Сюзанне Кук, Андреа Страковой, Марии Пелетейро, Сезалтине Семеду, Талите Мариане Морате Рапозо, Рафаэлю Рикардо Юппесу, Синтии Маркиори Буэно и жителям Манингриды. Мы благодарим членов ИТ-группы проекта Wellcome Trust Sanger Institute Cancer Genome и основного секвенирования и ИТ-оборудования Wellcome Trust Sanger Institute. Дополнительные источники поддержки включали долгосрочные стипендии EMBO (Lt-456-2010 (EPM) и ALTF-1287-2012 (IM)) и грант Марии Кюри IEF (JCMT). Данные о последовательности генома, представленные в этом исследовании, доступны под инвентарным номером [будет завершена] в Европейском архиве нуклеотидов.
Дополнительный контент включает материалы и методы, таблицы S1–S8 и ссылки (28–41).
1. Блейн Д.П. Отечественный трактат о болезнях лошадей и собак. Т. Бузи; Лондон: 1810. стр. 161–2. [Google Scholar]
Т. Бузи; Лондон: 1810. стр. 161–2. [Google Scholar]
2. Мерчисон EP. Онкоген. 2008; 27 (Приложение 2): S19–30. [PubMed] [Google Scholar]
3. Гангули Б., Дас У., Дас А.К. Вет Комп Онкология. 2013 г. опубликовано онлайн EpubAug 25 (10.1111/vco.12060) [PubMed] [Google Scholar]
4. Nik-Zainal S, et al. Клетка. 2012 25 мая; 149:994. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Gerlinger M, et al. Новая Англия J Med. 2012; 366: 883–892. [бесплатная статья PMC] [PubMed] [Google Scholar]
6. Александров Л.Б., и соавт. Природа. 2013 22 августа; 500:415. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Katzir N, et al. Proc Natl Acad Sci USA. 1985 Feb; 82:1054. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. vonHoldt BM, et al. Геном Res. 2011 Авг;21:1294. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Vonholdt BM, et al. Природа. 2010 8 апреля; 464: 898. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Murgia C, Pritchard JK, Kim SY, Fassati A, Weiss RA. Клетка. 2006 11 августа; 126:477. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Murgia C, Pritchard JK, Kim SY, Fassati A, Weiss RA. Клетка. 2006 11 августа; 126:477. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Cadieu E, et al. Наука. 2009 2 октября; 326:150. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Candille SI, et al. Наука. 2007 30 ноября; 318:1418. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Clark LA, Wahl JM, Rees CA, Murphy KE. Proc Natl Acad Sci USA. 31 января 2006 г.; 103:1376. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Dodman NH, et al. Мол Психиатрия. 2010 янв;15:8. [PubMed] [Google Scholar]
15. Everts RE, Rothuizen J, van Oost BA. Аним Жене. 2000 июнь; 31:194. [PubMed] [Google Scholar]
16. Hoopes BC, Rimbault M, Liebers D, Ostrander EA, Sutter NB. Геном Мамм. 2012 Декабрь; 23:780. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Schmutz SM, Berryere TG. Аним Жене. 2007 Декабрь; 38:539. [PubMed] [Google Scholar]
18. Sutter NB, et al. Наука. 2007 6 апреля; 316:112. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2007 6 апреля; 316:112. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Takeuchi Y, et al. Аним Жене. 2009 окт; 40:616. [PubMed] [Google Scholar]
20. Vaysse A, et al. Генетика PLoS. 2011 Окт;7:e1002316. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Axelsson E, et al. Природа. 2013 21 марта; 495:360. [PubMed] [Google Scholar]
22. Thomas R, Rebbeck C, Leroi AM, Burt A, Breen M. Chromosome Res. 2009;17:927. [PubMed] [Google Scholar]
23. Реббек К.А., Томас Р., Брин М., Лерой А.М., Берт А. Эволюция. 2009 Сентябрь;63:2340. [PubMed] [Академия Google]
24. Stephens PJ, et al. Природа. 2012 21 июня; 486:400. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Murchison EP, et al. Клетка. 2012 17 февраля; 148:780. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Miller W, et al. Proc Natl Acad Sci of U S A. 2011;108:12348–12353. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Larson G, et al. Proc Natl Acad Sci U S A. 5 июня 2012 г.; 109:8878. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Proc Natl Acad Sci U S A. 5 июня 2012 г.; 109:8878. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Lindblad-Toh K, et al. Природа. 2005 декабрь; 438:803. [PubMed] [Академия Google]
29. Li G, et al. Геном Res. 20 сен 2013; 23:1486. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Li H, Durbin R. Биоинформатика. 2009 15 июля; 25:1754. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Yang F, et al. Геномика. 1999 1 декабря; 62:189. [PubMed] [Google Scholar]
32. Jentsch I, Adler ID, Carter NP, Speicher MR. Хромосомный Рез. 2001; 9:211. [PubMed] [Google Scholar]
33. Van Loo P, et al. Proc Natl Acad Sci U S A. 2010 Sep 28; 107:16910. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Nilsen G, et al. Геномика BMC. 2012;13:591. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Nik-Zainal S, et al. Клетка. 2012 25 мая; 149:979. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Flicek P, et al.